Prof. Blumes Bildungsserver für Chemie
Tipp des Monats September 2019 (Tipp-Nr. 267)
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
„Hilfe, das Badewasser stinkt nach Stinkbombe!“ - Schwefelwasserstoff im Trinkwasser
Jens Schorn
Bild 1: Eine käufliche Stink- und Knallbombe
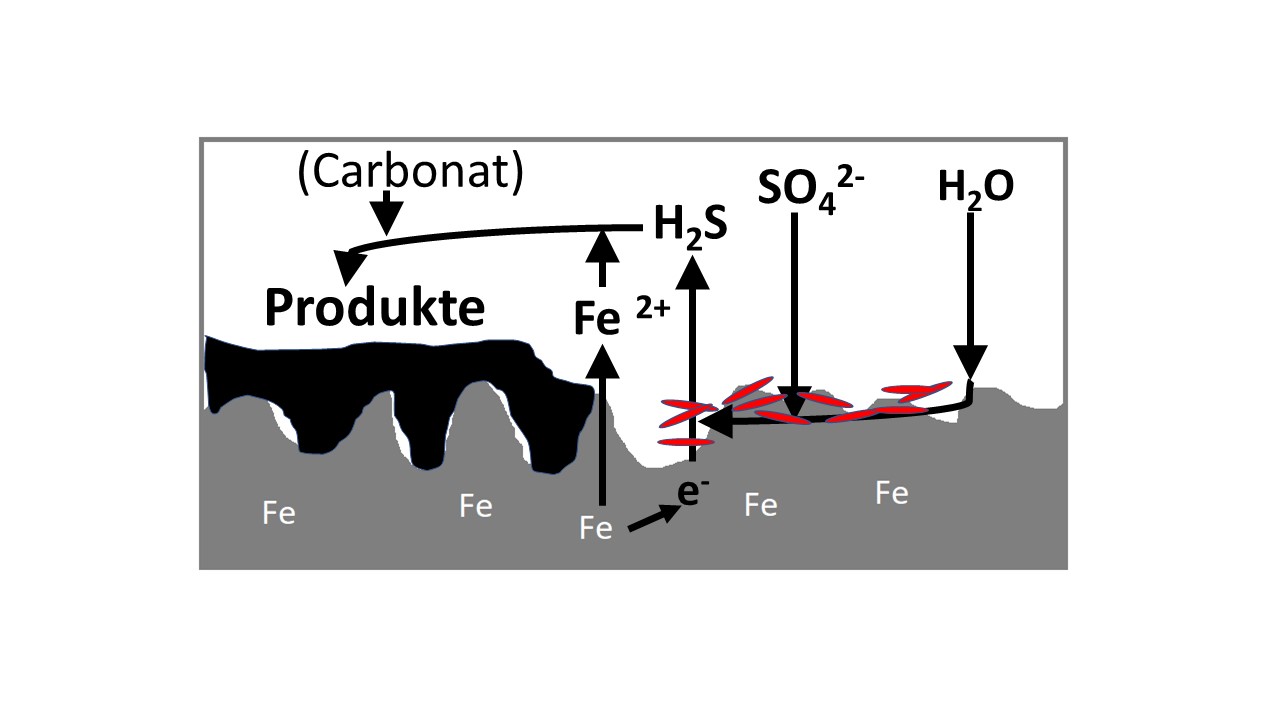
Als wir mit Freunden neulich in der Gegend von Zeuthen, südlich von Berlin, ein Wochenende in deren Häuschen verbrachten, hörte ich diesen Hilferuf aus dem Bad. „Hilfe, das Wasser stinkt nach Stinkbombe!“ Sofort wurde der Chemiker unter uns mit lauter Fragen bombardiert: „Kann man an diesem Gestank ersticken und ist das nicht giftig? Kann man das Wasser noch zum Waschen und Zähneputzen benutzen oder sogar noch trinken? Stinkt man danach nicht genauso wie das Wasser? Wie kommt der Gestank überhaupt ins Trinkwasser? Wer hat Schuld an dem Gestank im Wasser? Ist das der gleiche Stoff wie in den sogenannten Stinkbomben?“ Autowaschanlagen stinken so im heißen Sommer, Produkte der Verdauungsvorgänge stinken immer, die Verwesung von pflanzlichem oder tierischem Material stinkt auch, manch ein Mundgeruch riecht danach, wie jeder weiß. Die gemeinsame Ursache all dieser Vorgänge ist der Abbauprozess schwefelhaltiger Verbindungen durch Bakterien. Das Trinkwasser muss also schwefelhaltige Verbindungen enthalten und Bakterien müssen dies zu dem stinkenden Gas umwandeln. Der Grenzwert lt. Trinkwasserverordnung liegt bei 250 mg/L. Eichwalde: 102 mg/L; Wildau: 189 mg/L Den Anteil an Sulfat im Trinkwasser kann man z. B. als schwerlösliches Bariumsulfat nachweisen [3] Der nach unten gerichtete Pfeil bringt dies in der Reaktionsgleichung zum Ausdruck. Die Gleichung offenbart, dass Sulfat zu Sulfid reduziert wird. Bei diesem Vorgang werden formal Elektronen vom Schwefelatom aufgenommen. Es handelt sich im Sinne der erweiterten Definition von Redoxreaktionen daher um eine Reduktion: Da eine Reduktion nicht ohne gleichzeitige Oxidation abläuft, müssen Elektronen von einem anderen Stoff abgegeben werden. Es muss also ein Stoff oxidiert werden. In diesem Fall ist es der Wasserstoff. Ähnliche Prozesse laufen auch in der Natur ab, so zum Beispiel in der Tiefsee oder in „umgekippten“ Oberflächen-Gewässern. Wenn die Bakterien, die immer auch im Trinkwasser enthalten sind, den Wasserstoff von der Oberfläche des Boilers durch Desulfurikation entfernen, löst sich das Metall des Boilers langsam auf und die Bakterien können sich mit der bei diesem Prozess gewonnenen Energie fortpflanzen und vermehren. Außerdem entstehen aus den anderen Bestandteilen des Wassers und dem Schwefelwasserstoff weitere Sulfide, die sich als schwarze Produkte auf der Eisenoberfläche ablagern. Über längere Zeit läuft hier eine sogenannte Biokorrosion ab. Da diese Reaktion ohne Sauerstoff abläuft spricht man von der Anaeroben Biokorrosion. Bild 2: Anaerobe Biokorrosion (Eisen (grau), Bakterien (rot), Produkte (schwarz)
Der Metallbehälter wird zerstört und die Bakterien vermehren sich. In der gesamten Zeit entsteht Schwefelwasserstoff, der im Wasser gelöst vorliegt und beim Öffnen des Wasserhahns zu gasförmigem Schwefelwasserstoffgas (H2S) wird und den Gestank verursacht. Hier spielt der Druck die auslösende Rolle: Es handelt sich um ein chemisches Gleichgewicht, das bei Druckentlastung nach rechts verschoben wird: Für den Besitzer des Boilers oder der Warmwasseranlage hilft Erhitzen auf höhere Temperaturen nur kurzfristig, da die Bakterien sich nur durch sehr viel höhere Temperaturen über 70°C sicher abtöten lassen. Bei der Verwendung von hochwertigeren Armaturen mit kompletter Verchromung tritt diese Korrosion nur auf, wenn die Chromoberfläche zerstört wurde. Kann man den Gestank nicht mehr ertragen, muss man wohl die Armatur auswechseln. In höheren Konzentrationen ist Schwefelwasserstoff ein Giftgas mit der unangenehmen Eigenschaft unsere Geruchsrezeptoren zu betäuben, sodass wir den Stoff nicht mehr riechen können. Bei der Aufnahme von Schwefelwasserstoff über die Lungen in den Blutkreislauf wird der Blutfarbstoff Hämoglobin zerstört, was die eigentliche Giftwirkung des Gases in höheren Konzentrationen erklärt [6]. Bild 3: Käufliche Stink- und Knallbomben
Solche Produkte enthalten ein Gemisch aus einem Carbonat (meist Calcium- oder Natriumcarbonat) und einer Beimengung von Pyrrhotin, einem Mineral, das aus Eisen (II)-sulfid besteht. Bild 4: Schwefeleisen oder Pyrrhotin
Dieses Gemisch wird mit Salzsäure, die in einem zerdrückbarem Plastikbeutel enthalten ist, beim Starten zur Reaktion gebracht. Bild 5: Gasbildung nach dem Zerdrücken des Säurebeutels
Dabei entstehen Kohlenstoffdioxid und in geringen Mengen das in diesem Fall erwünschte Gas Schwefelwasserstoff aufgrund folgender Reaktionen: Vergleichbar kann man die Reaktion (8) auch im Labor zur Erzeugung von Schwefelwasserstoff nutzen. Bild 6: Zerriebenes Eisen (II)-sulfid in einer Porzellanschale mit Salzsäure vermischt. Auf dem Rand liegt Bleiacetatpapier zum Nachweis des entstehenden Schwefelwasserstoffs. Es färbt sich braun-schwarz.
Der in den Stinkbomben entstehende Schwefelwasserstoff ist schnell mit Bleiacetatpapier nachgewiesen. Weiteres hierzu klicke hier. Unsere Nase ist aber in diesem Fall ein ebenso guter Indikator für den Geruch nach dem Platzen einer solchen Stinkbombe. Bild 7: Stinkbomben kurz vor dem Platzen
Die Stinkbombe platzt durch den entstehenden Gasdruck und der Schwefelwasserstoff entweicht und erzeugt einen einprägsamen aber kurzweiligen Eindruck bei den Umstehenden. Die Konzentrationen sind aber unbedenklich und so kann die Stinkbombe für 40 Eurocent getrost als billiger Scherzartikel betrachtet werden - während die Zerstörung des Warmwasserboilers im Bad unserer Freunde in Zeuthen mit Sicherheit höhere Kosten verursachen wird.

(Foto: Schorn)
Wie kommt der Gestank überhaupt ins Trinkwasser? Wer hat Schuld an dem Gestank im Wasser?
Interessanterweise stellte man schnell fest, dass der Gestank aus der Warmwasserleitung kam und das kalte Wasser eher geruchlos war. Eine Bedingung für die Entstehung des Gestanks in dieser Situation ist tatsächlich eine bestimmte Temperatur. Vergleicht man mit anderen Situationen im Alltag, in denen der Gestank auftreten kann, so stellt man weitere Bedingungen fest, die zur Entstehung des fürchterlichen Gestanks nach Stickbomben beitragen.
Woher kommen schwefelhaltige Verbindungen?
Eine Gruppe von schwefelhaltigen Verbindungen des Trinkwassers sind Sulfate – gemeinsam ist allen, dass sie diese Salze das Sulfat-Ion (SO42-) enthalten. Im Trinkwasser von Eichwalde [1] und Wildau [2] kommt es in erhöhtem Maße natürlich vor.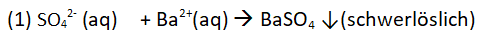
Welche Bedeutung haben Bakterien bei der Entstehung des Gestanks?
Die hier vorkommenden Bakterien gehören zu der Gruppe der Archaebakterien, die in der Lage sind auch bei hohen Temperaturen (über 80 °C) zu überleben und den Sulfatanteil des Trinkwassers als Oxidationsmittel zur Energiegewinnung zu nutzen und in Sulfid umzuwandeln. Diesen Vorgang nennt man Desulfurikation [4].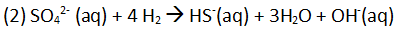
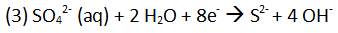
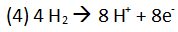
Wie kommt der Wasserstoff in den Warmwasserboiler?
Da der Warmwasserboiler u. a. aus Eisen besteht, entsteht an der Kontaktfläche zu Wasser Wasserstoff.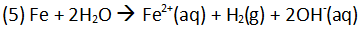
(Bild: Schorn)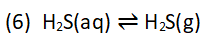
Kann man an diesem Gestank ersticken und ist das nicht giftig?
Jeder hat diesen Geruch schon einmal in der Nase gehabt, ob nun aus dem Trinkwasser oder von Stinkbomben, die man früher als Kinderstreich verwendet hat oder von faulen Eiern, nach denen der Geruch meist auch benannt wird. Die Geruchsschwelle liegt bei 0,02 ppm. In allen Fällen geht der Geruch von Schwefelwasserstoff aus. Die Konzentration von Schwefelwasserstoff, die dabei entsteht, liegt im Bereich der Schwefelbäder von Kurbädern. Ist also nicht gesundheitsschädlich; vielmehr sollen solche Konzentrationen durchblutungsfördernd, und gut für den Bewegungsapparat und die Haut unseres Körpers sein.
Kann man das Wasser noch zum Waschen und Zähneputzen benutzen oder sogar noch trinken? Stinkt man danach nicht genauso wie das Wasser?
Schwefelwasserstoff hat eine geringe Löslichkeit in Wasser von 2,61 L/L [7], aber einen hohen Dampfdruck. Das heißt, es löst sich nicht gut in Wasser und entweicht gerade bei höheren Temperaturen recht schnell aus dem Wasser. Sollte man heiß duschen, so kann ein gewisser Anteil des gelösten Schwefelwasserstoffs in die Lungen gelangen und zu Reizungen führen, sodass man ein Nutzen hier einschränken sollte. Eine Reizung von Schleimhäuten an Auge und Atemwegen findet ab ca. 100 ppm in der Luft statt. Das entspricht 100 Mikroliter/L Luft. Das Trinken und das Zähneputzen sollten in geringem Umfang unbedenklich sein.
Ist das der gleiche Stoff wie in den sogenannten Stinkbomben?
Nach der Bedarfsgegenständeverordnung §3 [8] in der Anlage 1 sind in Deutschland nur noch Stinkbomben ohne Ammoniumsulfid, Ammoniumhydrogensulfid und Ammoniumpolysulfiden zugelassen. Dementsprechend kann man Stinkbomben kaufen, in denen meist ein Mineral getrennt von einer Säure vorkommt.
(Foto: Schorn)
(Foto: Schorn)
(Foto: Schorn)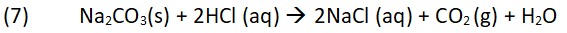
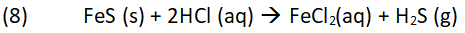

(Foto: Schorn)
(Foto: Schorn)
Quellen:
[1] https://www.mawv.de/files/content/service/Wasserwerke/2018_MAWV_Trinkwasserparameter_Wasserwerk%20Eichwalde.pdf (abgerufen am 28.8.2019)
[2] https://www.mawv.de/files/content/service/Wasserwerke/2018_MAWV_Trinkwasserparameter_WW%20Wildau.pdf (abgerufen am 28.8.2019)
[3] http://www.chemieunterricht.de/dc2/schwefel/s-so4-nachw.htm (abgerufen am 28.8.2019)
[4] https://www.biogas-akademie.de/images/stories/Bilder/BHKW-Bilder/Ursachen_und_Mechanismen_der_Korrosion_in_biologischen_Anlagen.pdf (abgerufen am 28.8.2019)
[5] verändert nach https://www.biogas-akademie.de/images/stories/Bilder/BHKW-Bilder/Ursachen_und_Mechanismen_der_Korrosion_in_biologischen_Anlagen.pdf (abgerufen am 28.8.2019)
[6] https://schwefelwasserstoff.de/data/documents/schwefelwasserstoff.pdf (abgerufen am 28.8.2019)
[7] https://sgdsued.rlp.de/fileadmin/sgdsued/Dokumente/Bekanntmachungen/Westheim_Bioabfallvergaerung/Datenblatt_Schwefelwasserstoff.pdf (abgerufen am 28.8.2019)
[8] http://www.gesetze-im-internet.de/bedggstv/anlage_1.html (abgerufen am 28.8.2019)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 10. September 2019, Fritz Meiners