Prof. Blumes Bildungsserver für Chemie
Tipp des Monats September 2021 (Tipp-Nr. 291)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Uwe Lüttgens
Im Sommer stehen Kaltgetränke hoch im Kurs. Rasch zum Kühlschrank und – wir müssen verstellen, dass wir vergessen haben, diesen tags zuvor mit den gewünschten Kaltgetränk wieder aufzufüllen. Was tun? Es müssen Eiswürfel her; zum Glück wartet das kristalline Wasser bei uns im 3-Sterne-Kühlfach bei – 18 °C auf seinen Einsatz. Zwei, drei eiskalte Würfel in die Cola, den Orangensaft oder den zimmerwarmen Eistee, einmal umrühren, etwas warten – schon ist das Getränk erfrischend kühl. Bild 1: Eiswürfel sorgen für eine rasche Abkühlung eines jeden Kaltgetränks
Beim genüsslichen Schlürfen kommen naturwissenschaftlich Interessierte leicht ins Grübeln. Zwei Fragen tun sich auf. Die erste: Warum kühlt eigentlich der Eiswürfel? Klinkt vielleicht trivial. Die häufig gegebene Antwort: „Na, weil er halt kalt ist.“ klingt ebenso trivial. Versuchen wir´s mit 2 Eiswürfeln von je 12 ml Volumen bei einer Wassermenge von 300 ml: Aus der Berechnung würden wir also bei 2 Eiswürfeln von je 12 g und einer Wassermenge von 300 ml bei einer Starttemperatur von 19 °C eine Endtemperatur von ca. 16 °C erwarten. Und nun rechnen wir mit 3 Eiswürfeln derselben Masse: Hier würden wir eine um 1 °C niedriger Endtemperatur von immer noch 15 °C erwarten. Betrachten wir unserem Fall: Die Wärmekapazität von Eis beträgt cEis = 2,06 J·g-1·K-1; die von flüssigem Wasser ist doppelt so hoch. Sie betägt cWasser = 4,18 J·g-1·K-1. Die Wärmekapazität des Eises ist also ungefähr halb so groß ist wie die von flüssigem Wasser. Mit dieser Formel fällt interessanterweise der theoretisch vorausgesagte Abkühlungsprozess noch geringer aus als mit der „einfachen“ Formel. Wer mag, kann dies´ rechnerisch prüfen. Versuch 1: Schmelzen von Eiswürfeln - Messung des Temperaturverlaufs Geräte und Chemikalien: Gläser oder Bechergläser, Leitungswasser, Eiswürfel (evt. angefärbt), Thermometer, Stoppuhr Durchführung: Ein Glas wird mit Wasser gefüllt und die Temperatur gemessen. Anschließend werden zwei bis drei Eiswürfel hinzugegeben. Gleichzeitig wird eine Stoppuhr gestartet. In regelmäßigen Abständen, z.B. alle 30 Sekunden, wird die Temperatur des Wassers mittig im Glas bestimmt. Hinweis: Während der Messung kann ab und zu umgerührt werden. Ergebnis: In beiden Versuchen kühlt sich das Wasser stark ab. Je mehr Eiswürfel schmelzen, desto stärker sinkt die Temperatur. Die Endtemperatur bei zwei Eiswürfeln beträgt nach 10 Minuten ca. 11 °C, bei drei Eiswürfeln sind es 7 °C nach 0,6 Stunden.

(Foto: Lüttgens)
Eis und Wasser durchmischen sich – eine erste Hypothese
Versuchen wir uns mal an dieser ersten Annahme. Nennen wir sie Mischungshypothese. Kann das die Erklärung sein? Die Frage lautet dann: Lässt sich die Temperatur des gekühlten Getränks durch eine Berechnung voraussagen? Ergibt sie sich einfach aus der Temperatur der Eiswürfel und der Temperatur des flüssigen Wassers. Unsere Mischungsformel lautet: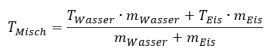


Für Spezialisten: Die Riechmann´sche Mischungsregel
Die „einfache“ Mischungsformel, die wir angewendet haben, müsste korrigiert werden, da das Wasser in zwei unterschiedlichen Aggregatzuständen – fest und flüssig – vorliegt. Korrekt gewesen wäre die Riechmann´sche Mischungsregel [1], die die unterschiedlichen Wärmekapazitäten zweier miteinander zu mischenden Flüssigkeiten berücksichtigt: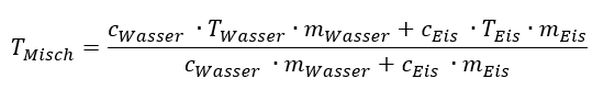
... und ein einfacher Versuch
Und nun führen wir diesen einfachen Versuch durch:
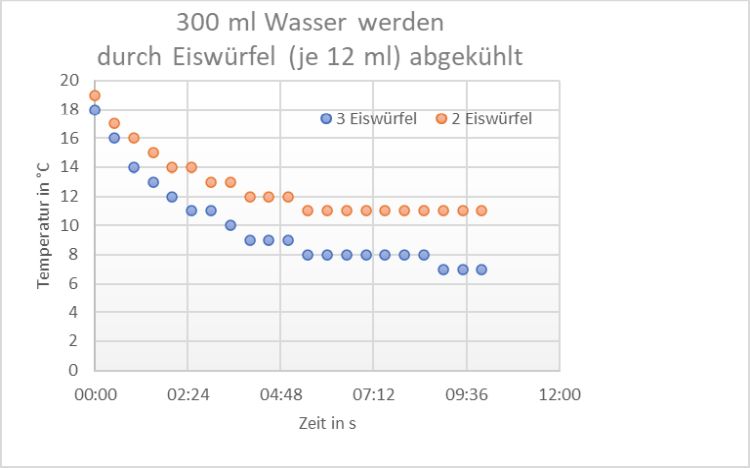
Wie wir sehen: Der Messwert – bei 3 Eiswürfeln 7 °C – und der kalkulierte Wert von 15 °C weichen deutlich voneinander ab. Die Mischungshypothese kann nicht stimmen.
Ist das Schmelzen des Eiswürfels entscheidend?
Gehen wir also dem Vorgang etwas tiefer auf den Grund und wechseln dabei die Blickrichtung: Es erscheint sinnvoll, die Wärme zu betrachten, die aus dem Wasser kommt und dafür sorgt, dass der Eiswürfel schmilzt [2,3].
Wir können wir vorgehen? Häufig in den Naturwissenschaften angewendeter „Trick“ ist es, einen Prozess – in unserem Fall die Abkühlung des Kaltgetränks nach der Zugabe der Eiswürfel – zu unterteilen in mit Formeln berechenbare Phasen. Drei Phasen des Abkühlungsprozesses erscheinen sinnvoll:
1. Phase: Aufwärmen des Eiswürfels von – 18°C auf 0°C nach der Zugabe des Eises. Wieviel Wärmeenergie ist dafür notwendig?
Zuvor überlegen wir, wovon diese Wärme Q abhängig ist. Sicherlich von der Masse m des Eiswürfels. Je mehr Eiswürfel wir nehmen, desto mehr Wärme ist für den Schmelzvorgang notwendig. Und auch die Temperaturänderung ΔT muss eine Rolle spielen. Je kälter die Eiswürfel sind, desto mehr Wärme wird nötig sein, um flüssiges Wasser zu produzieren. Schließlich muss noch die Wärme, die der Stoff „Eis“ speichern kann, berücksichtigt werden – dieses Wärmespeichervermögen ist nämlich bei jedem Stoff anders. Man spricht von der Wärmekapazität c eines Stoffes. Diese wurde ja weiter oben bereits erwähnt. Damit ergibt sich folgende Formel:
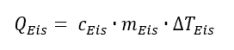
Die Temperatur nach der Erwärmung der Eiswürfel lässt sich nun in zwei Schritten berechnen. Da diese Wärme vom Wasser des dabei langsam abkühlenden Getränks geliefert wird, kühlt es sich ab. Die Berechnung der Temperaturänderung des Wassers durch die Erwärmung des Eiswürfels ergibt sich nach einer Umformung der Gleichung:
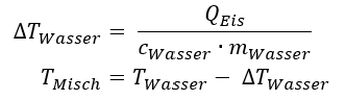
Welche Werte ergeben sich?
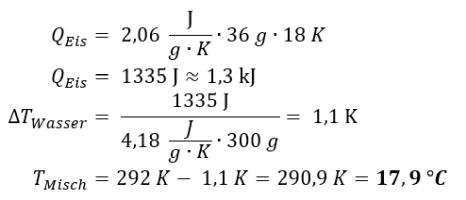
Dies wäre die Temperatur des Kaltgetränks, bevor sich der Eiswürfel bei 0 °C in flüssiges Wasser verwandelt. Nun, eine Temperatur von 18 °C wäre nicht besonders eindrucksvoll, wenn vorher das Wasser eine Temperatur von 19 °C hatte; man könnte wohl kaum von einem Kaltgetränk sprechen. Schauen wir uns mal die nächste Phase genauer an.
2. Phase: Schmelzen des 0°C kalten Eiskristalls – wir reden von der Schmelztemperatur oder dem Schmelzpunkt – zu 0°C kaltem Wasser. Das Wasser ändert dabei seinen Aggregatzustand von fest zu flüssig. Die Temperatur ändert sich dabei nicht. Die Energie, die notwendig ist, um die Wassermoleküle, die im Eiskristall durch Wasserstoffbrückenbindungen relativ fest miteinander verbunden sind, voneinander zu trennen, damit sie sich frei bewegen können – nichts anderes passiert, wenn der Eiskristall schmilzt –, muss aus der Umgebung, also dem flüssigen Wasser des Kaltgetränks kommen.
Zur Berechnung gibt´s auch eine Formel:
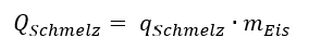
mit der spezifischen Schmelzwärme von Eis von qSchmelz = 334 J/g.
Welche Temperatur ergibt sich durch das Schmelzen des Eiswürfels?
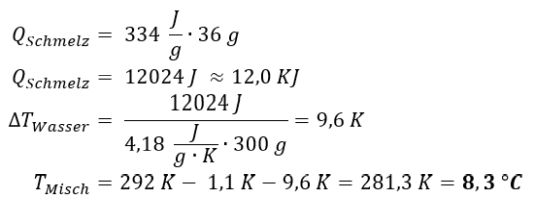
Dieser Wert von ca. 8 °C passt sehr gut zur gemessenen Endtemperatur von 7 °C im Experiment mit den 3 Eiswürfeln. Halten wir fest: Das Schmelzen des Eises entzieht jedem Getränk soviel Wärme, dass es deutlich abkühlt!
3. Phase: Vermischung des 0°C kalten Wassers mit dem lauwarmen „Kaltgetränk“. Diese Berechnung kannst du nun selbst durchführen, wenn du den Artikel bis hierhin aufmerksam gelesen hast. So viel sei verraten: Auf die Temperatur des Kaltgetränks hat diese Phase keinen großen Einfluss mehr, ebenso, wie die 1. Phase.
Gut, wir wissen, dass ein Eiswürfel sofort zu schmelzen beginnt, wenn er Leitungswasser geworfen wird. Die theoretische Zerlegung des Vorgangs führt trotzdem zum gewünschten Ziel: Eine genauere Übereinstimmung von Theorie und Experiment.
Die Zahl der Eiswürfel – ein Optimierproblem
Eine zweite Frage, den man sich stellen könnte, während das Kaltgetränk in der Hand langsam wieder warm wird: Wie viele Eiswürfel brauche ich eigentlich, um ein – sagen wir mal 2° kaltes Getränk herzustellen? Einen, zwei, drei oder doch lieber sieben, wie es eine Freundin mit ihrem Rotwein getan hat?

Bild 2: Sieben Eiswürfel sorgen für eine starke Abkühlung – auch von Rotwein
(Foto: Lüttgens)
Auch diese Abschätzung lässt sich sicherlich durchführen, wenn man die in diesem Tipp genutzten Formeln umformt und die gewünschte Temperatur des Kaltgetränks als Konstante eingesetzt wird, dass sich die Eismasse berechnen lässt. Viel Erfolg!
Literatur:
[1] Riechmannsche Mischungsregel; https://de.wikipedia.org/wiki/Richmannsche_Mischungsregel (zuletzt abgerufen am 6.8.2021)
[2] Cooling drinks with ice cubes (Derivation and calculation with formula); tec-science, 2021; https://www.tec-science.com/thermodynamics/heat/cooling-drinks-with-ice-cubes (zuletzt abgerufen am 6.8.2021)
[3] How Does Ice Cool Drinks?; Jeremy Shere, 2012; https://indianapublicmedia.org/amomentofscience/ice-cool-drinks.php (zuletzt abgerufen am 6.8.2021)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 7. September 2021, Fritz Meiners