Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juli 2022 (Tipp-Nr. 301)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Chemisches Gleichgewicht und das Pilotenspiel
Jens Schorn
„Gefährliches Ohnmachtsspiel auf Berliner Schulhof“
Die Schulrealität liegt manchmal näher am naturwissenschaftlichen Chemieunterricht, als man es sich wünscht. So machte ein Artikel der Berliner Morgenpost auf eine Form von Ohnmachtsspiel aufmerksam. Wie im Artikel beschrieben, werden Kinder in der Pause von einer Gruppe von Mitschülern angesprochen und motiviert an einem „ganz besonderen Spiel“ teilzunehmen. Dazu soll man sich in die Hocke setzen und hyperventilieren. Anschließend soll man ganz schnell aufstehen und ein Mitschüler drückt einem dann am Hals kurz die Luft ab. Man sackt zu Boden und das gezielte Herbeiführen einer Ohnmacht löst einen Adrenalin-Kick aus. Das sogenannte Pilotenspiel ist auch auf Berlins Schulhöfen nicht neu, allerdings erfolgt die Verbreitung über die sogenannten sozialen Medien wie TikTok oder Youtube schneller, da die Kinder hier entsprechend leicht zugängliche Anleitungen zu dem „Spiel“ erhalten. Dieses Vorgehen ist auch unter den Begriffen Tomatenspiel, Flatline, Space Monkey oder dem (indischen) Traum bekannt [2]. Von Medizinern wird als Folge der Hyperventilation eine ursächliche Sauerstoffüberversorgungen genannt, die dann zu einer Ohnmacht führt. In vielen Fällen gelangt man nicht wieder schnell zu Bewusstsein und es entstehen evtl. Langzeitfolgen. Experiment: Untersuchung des Carbonat-Gleichgewichts Material: Destilliertes Wasser, Kohlenstoffdioxid, Bromthymolblau, Lackmuslösung, zwei 50mL Kunststoffspritzen mit Verschlussstopfen, Ammoniaklösung 25%ig, zwei Bechergläser 50mL, Tropfpipette. Durchführung A:
Bild 2: Bromthymolblau (links) bzw. Lackmuslösung (rechts) mit destl. Wasser gemischt
Bild 3: Beide Indikatorlösungen mit einem Tropfen Ammoniaklösung versetzt
Bild 4: Spritzen mit CO2 und Indikatorlösung gefüllt. Zum Vergleich die ursprünglichen Indikatorlösungen in den Bechergläsern
Bild 5: Spritzen mit CO2 gefüllt, geschüttelt und komprimiert
Durchführung B:
Bild 6: Restgas wurde entleert
Bild 7a, 7b, 7c: Mit Bromthymolblau gefärbte Lösungen bei herrschendem Unterdruck von links nach rechts nach mehrmaligem Schütteln.
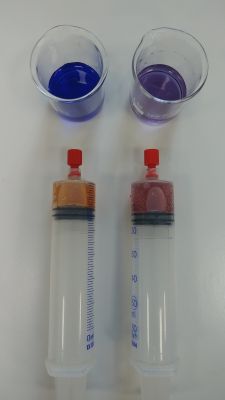
Bild 9a-b: Indikatoransätze nach mehrmaligem Schütteln bei herrschendem Unterdruck (links) und mit Luft ergänzt (rechts)
Beobachtungen A:
Beobachtungen B: Ergebnis: Durch das Ergänzen von Ammoniak werden beide Ausgangslösungen alkalisch und die Säure-Base Indikatoren zeigen dies durch einen Farbumschlag an. Der Farbumschlagsbereich für Bromthymolblau liegt von pH 6,0-7,6. Für Lackmus liegt der Bereich in dem der Indikator die Farbe wechselt zwischen pH 5,0-8,0 [3]. Löst man durch Schütteln und Druckerhöhung Kohlenstoffdioxid in den alkalischen Indikatorlösungen, so zeigen die Indikatorlösungen eine Änderung des pH-Werts zum sauren Bereich an. Erzeugt man Unterdruck durch das Herausziehen der Kolbenspritzen, so kann man diesen Vorgang wieder rückgängig machen. Die Indikatorlösungen schlagen wieder um und zeigen damit höhere pH-Werte an.
Überschrift in der Berliner Morgenpost vom 20.3.2022 [1].
Was hat dieses „Pilotenspiel“ aber mit Chemie und mit dem chemischen Gleichgewicht zu tun?
Um die chemischen Ursachen der Ohnmachtsentstehung im Unterricht modellhaft abzubilden, kann man folgendes Experiment modellhaft durchführen.

(Foto: Schorn)
(Foto: Schorn)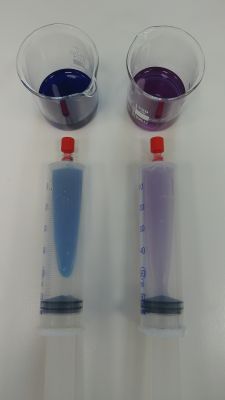
(Foto: Schorn)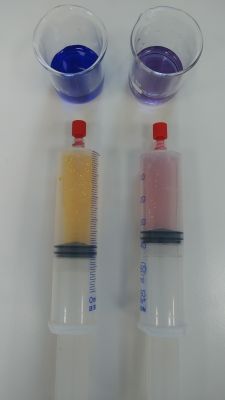
(Foto: Schorn)
(Foto: Schorn)
(Fotos: Schorn)
(Fotos: Schorn)
Nach dem Herausziehen der Kolben verfärbt sich Bromthymolblau wieder von gelb nach grünlich bis hin zu blau. Der Ansatz mit der Lackmuslösung verfärbt sich wieder etwas bläulich.
Das chemische Gleichgewicht, das man zur Erklärung des Experiments verwendet, ist das sogenannte Carbonat-Gleichgewicht. Es besteht aus drei Teilreaktionen.
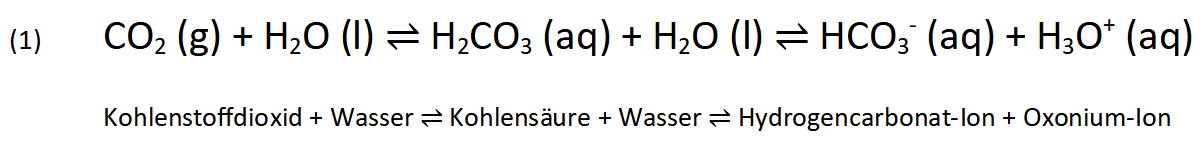
Zwei Teilreaktion vom Kohlenstoffdioxid über die Kohlensäure zum Hydrogencarbonat-Ion.
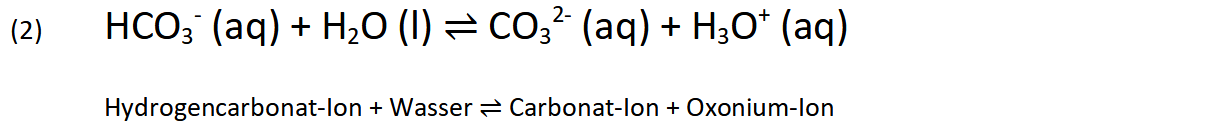
Eine Teilreaktion vom Hydrogencarbonat-Ion zum Carbonat-Ion.
Hieran erkennt man in der ersten Gleichung (1), dass durch die Verbindung von Kohlenstoffdioxid mit Wasser über eine Zwischenstufe, der unbeständigen Kohlensäure, sogenannte Hydrogencarbonat-Ionen und Oxonium-Ionen entstehen. Die Oxonium-Ionen sind die Teilchen, die eine Lösung sauer machen. Liegen diese Teilchen in der Lösung im Überschuss vor, so färben sich unsere hier verwendeten Indikatoren gelb (Bromthymolblau) bzw. rot (Lackmus).
Dieses chemische Gleichgewicht, das sich zwischen der Hin- und Rückreaktion eingestellt hat, kann man nun nach dem Prinzip des kleinsten Zwangs durch Druckveränderung nach links bzw. nach rechts verschieben.
Dieses Prinzip, das man auch das Prinzip von Le Chatelier bzw. von Braun nennt, beschreibt die Veränderung einer chemischen Reaktion, die sich im Gleichgewicht befindet, wenn man auf diese chemische Reaktion z.B. einen Druck ausübt, die Temperatur oder die Stoffmengenkonzentration der beteiligten Stoffe ändert.
In unserem Fall beschränken wir uns nur auf die Druckveränderung und deren Auswirkung auf das Carbonat-Gleichgewicht.
Erhöht oder verringert man den Druck, so wirkt sich dieser Zwang direkt nur auf die linke Seite des chemischen Gleichgewichts in der Gleichung (1) aus, weil nur an dieser Stelle ein Gas, das Kohlenstoffdioxid, an der chemischen Reaktion beteiligt ist.
Alle anderen Stoffe im Carbonat-Gleichgewicht liegen als Flüssigkeit oder gelöst vor. Deren Zustand wird durch Druckänderung praktisch nicht beeinflusst.
Was passiert bei einer Druckverringerung, also wenn man wenig Kohlenstoffdioxid im Blut hat, mit diesem chemischen Gleichgewicht?
Vergleichen wir die Situation beim Pilotentest mit dem Experiment Variante B, so wird bei einer Hyperventilation viel Kohlenstoffdioxid aus der Lunge ausgeatmet und als Folge sinkt die Konzentration der Kohlenstoffdioxidteilchen in der Lunge und in den Lungenbläschen. An der Fläche, an der der Gasaustausch zwischen Blut und den Lungenbläschen stattfindet, sinkt also der Teildruck des Atemgases Kohlenstoffdioxid. Dies gleicht einer Druckverringerung, die sich auf die chemische Reaktion (1) so auswirkt, dass Kohlenstoffdioxidmoleküle aus dem Blut nachgebildet werden. Der sogenannte Partialdruck von Kohlenstoffdioxid im Blut sinkt. In der Medizin spricht man hierbei von einer Hypokapnie. Die chemische Reaktion (1) reagiert von rechts nach links. Es handelt sich hierbei also um die Rückreaktion, bei der die Konzentration der Kohlensäure, der Hydrogencarbonat- und der Oxonium-Ionen sinkt.
Wenn die Konzentration der Oxonium-Ionen in einer wässrigen Lösung sinkt, dann verändert sich der pH-Wert und steigt an. Steigt der pH-Wert über 7,45 spricht man in der Medizin von einer respiratorischen Alkalose, weil der pH-Wert über dem Schwankungsbereich von pH= 7,35 – 7,45 liegt. Liegt der pH-Wert unter 7,35 so spricht man von einer Azidose, obwohl man aus chemischer Sicht erst ab einem pH-Wert von 6,9 von einer aziden, also sauren, Lösung spricht.
In einer einfachen Kausalkette kann man den Zusammenhang leichter überblicken.
- Hyperventilation
- CO2 Abnahme in der Lunge (Hypokapnie)
- Chemisches Carbonat-Gleichgewicht (1) verschiebt sich nach links
- Senkung der Konzentration der Säureteilchen im Blut
- Blut pH-Wert steigt an (respiratorische Alkalose)
Die Beobachtungen B (Bild 7a-7c) des oben gezeigten Experiments verdeutlichen diese pH-Wertänderung mit Hilfe der Farbveränderung des Indikators von gelb nach blau. Bei einer Druckverringerung wird das chemische Carbonat-Gleichgewicht also nach links verschoben und als Folge daraus steigt der pH-Wert an, weil die Konzentration der Oxonium-Ionen (H3O+) abnimmt.
Welche Folgen hat eine Alkalose im menschlichen Blut?
Neben neurologischen Störungen treten zwei weitere Folgen im menschlichen Körper auf.
- Durch einen erhöhten pH-Wert wird der an die roten Blutkörperchen (an das Hämoglobin) gebundene Sauerstoff erschwert an das Myoglobin im Muskelgewebe abgegeben. Als Ergebnis wird das Muskelgewebe nicht mit dem nötigen Sauerstoff versorgt [4].
- Aufgrund des hohen pH-Werts wird dem Gehirn bzw. den dortigen Blutgefäßen vermittelt, dass aufgrund der sehr geringen Konzentration an Kohlenstoffdioxid im Blut gleichzeitig viel Sauerstoff verfügbar sein müsste. Das führt dazu, dass sich die Blutgefäße im Gehirn zusammenziehen, der Blutstrom zum Gehirn und die Sauerstoffversorgung des Gehirns sinken. Die Folgen eines Sauerstoffmangels im Gehirn können vom Schwindelgefühl bis zum Absterben von Gehirngewebe reichen.
Auch dieser Zusammenhang lässt sich kausal übersichtlich darstellen (Kausalkette 2):
- Alkalose mit hohem pH-Wert
- Blutgefäße im Gehirn verengen sich
- Blutzufuhr sinkt
- Sauerstoffversorgung sinkt
- Schwindelgefühl setzt ein
Als Schutzmechanismus fällt der Körper in Ohnmacht, um durch eine horizontale Körperlage die Sauerstoffzufuhr über eine einfachere Blutzufuhr zum Gehirn zu steigern.
Auf einem einfachen Wege kann man aber schon im Vorfeld einer Ohnmacht, eine Gegenmaßnahme ergreifen. Dies macht es notwendig, sich mit der Wirkung einer Zunahme von Kohlenstoffdioxid im Blut zu beschäftigen.
Was passiert mit dem Carbonat-Gleichgewicht, wenn man dem menschlichen Blut in Folge einer Alkalose Kohlenstoffdioxid zuführt?
Im Mittelpunkt steht wieder das Carbonat-Gleichgewicht (1) mit dem Experiment in der in der Variante A.
Anhand der beiden Kausalketten 1 und 2 kann man die Zusammenhänge übersichtlich in umgekehrter Weise darstellen (Kausalketten 3 und 4):
- Rückatmung von CO2
- CO2 Zunahme in der Lunge
- Chemisches Carbonat-Gleichgewicht (1) verrschiebt sich nach rechts
- Zunahme der Konzentration der Säureteilchen im Blut
- Blut pH-Wert sinkt - Normalwert wird erreicht
- Normaler pH-Wert
- Blutgefäße im Gehirn weiten sich
- Blutzufuhr steigt
- Sauerstoffversorgung steigt
- Schwindegefühl verschwindet
Abschließend zeigt sich, dass durch die absichtlich herbeigeführte Senkung der Kohlensäure im Blut eine Verschiebung des im Experiment gezeigten Carbonat-Gleichgewichts zu einer respiratorischen Alkalose führt. Dies kann zu schwerwiegenden Schäden unseres Gehirns führen, sodass man von diesem sogenannten „Pilotenspiel“ nur dringend abraten muss.
Wenn Schülerinnen und Schüler aber aus anderen Gründen zur Hyperventilation neigen und Schwindelgefühle bekommen, so wird von zu Hilfe gerufenen Sanitätern empfohlen in eine Papiertüte zu atmen, sodass man sein ausgeatmetes Kohlenstoffdioxid durch Rückatmung wieder einatmet. Die Folgen davon sind in den Kausalketten 3 und 4 dargestellt. Man kommt wieder zu sich und der Schwindel verschwindet wieder.
Quellen:
[1] Dolif, Nicole; Berliner Morgenpost; 20.3.2022 https://www.morgenpost.de/berlin/article234859965/Schueler-spielen-gefaehrliches-Ohnmachtsspiel.html
[2] https://www.sn.at/panorama/oesterreich/13-jaehriger-strangulierte-sich-bei-wuergespiel-und-starb-1471201
[3] Elemente Chemie 2; Liebenow, K; Glaser, M.; u.a.; 1. Auflage 2010; Klett Verlag; Stuttgart
[4] Schmidt, F.R.; Memorix Spezial – Physiologie S. 206-207; VCH Verlagsgesellschaft, Weinheim 1992
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 2. Juli 2022, Fritz Franzke