Prof. Blumes Bildungsserver für Chemie
Tipp des Monats April 2024 (Tipp-Nr. 321)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
John Dalton oder die Frage, wie schwer Atome sind
Uwe Lüttgens
Woher wusste Dalton, wie schwer die Atome sind? Wie konnte er die Masse eines Atoms überhaupt messen? Zwei spannende Fragen, die sich stellen, wenn wir erstmals in die Welt der Chemie eintauchen. Es geht um Grundlegendes, um den Aufbau aller chemischen Stoffe, die uns umgeben. Bild 1: Konnte John Dalton Atome wiegen?
Schon der Naturphilosoph DEMOKRIT (460 – 371 v.Chr.) dachte darüber lange vor dem Beginn der modernen Wissenschaften nach. Er lebte im antiken Abdera, einer Stadt, in der nach Ansicht des römischen Schriftstellers CICERO die Dummheit zu Hause gewesen sei, als er aussprach: „Hic Abdera!“ [1] In dieser Stadt nun philosophierte DEMOKRIT, beeinflusst von seinem Lehrer LEUKIPP (5. Jahrhundert), wie denn eigentlich alles um sie herum aufgebaut sein könnte. Die Welt sollte nur aus Materie und leerem Raum bestehen. Und die Materie sollte aus kleinen Bausteinen bestehen. Um es deutlich zu sagen: Diese Vorstellungen der Atomisten wichen deutlich von den damals etablierten Lehrmeinungen ab, dass alles aus nur vier Elementen bestehe – Feuer, Erde, Wasser und Luft. „Nur scheinbar hat ein Ding eine Farbe, nur scheinbar ist es süß oder bitter, in Wirklichkeit gibt es nur Atome im leeren Raum.“, so meinte DEMOKRIT. [2] Nun, die Ansicht, dass alle Stoffe aus kleinsten, nicht weiter zerlegbaren Teilchen, den Atomen, bestehen, sollte sich später, viel später, als alles andere denn als dumm herausstellen. Übrigens: Das griechische Wort atomos heißt so viel wie kleinstes Teilchen oder unteilbar.

(Foto: Lüttgens)
DALTONS Hypothese von den Atomen
Machen wir einen Zeitsprung von vielleicht 2400 Jahren. Zu den Anfängen der modernen Chemie am Ende des 18. und zu Beginn des 19 Jahrhunderts. In dieser Zeit entwickelte in England der Naturforscher JOHN DALTON (1766 - 1844) seine Grundlagen der Atomtheorie, ein Atommodell, das er 1808 veröffentlichte [3]. Eigentlich war es das griechische Denkmodell von DEMOKRIT, dass Stoffe aus kleinsten Teilchen, den Atomen bestehen. Eine faszinierende Idee, dachte DALTON, als er damit die Vorstellungen der griechischen Atomisten aufgriff. Bereits im 17. und 18. Jahrhundert gingen „moderne“ Naturphilosophen davon aus, dass Materie aus harten, massiven Partikeln, also aus Atomen, aufgebaut sei, die durch mechanische Stöße miteinander wechselwirken und aneinanderlagern können, um komplexere Strukturen zu bilden. Das Atommodell war geboren:
ISAAC NEWTON (1643 – 1727) ging einen Schritt weiter, als er deutlich vor DALTON annahm, dass zwischen kleinsten Teilchen Kräfte wirken müssten, die deren chemisches Verhalten bestimmen würden.
Aber wie gelangte DALTON zu seinen Erkenntnissen, welches Gewicht – richtiger wäre es, von der Masse zu sprechen – ein Atom hat, wenn es dafür gar kein Messinstrument gab. Eine interessante Frage, um die es in diesem Tipp gehen soll. [4]
Wie ist Luft zusammengesetzt?
JOHN DALTON beobachtete schon lange Wetterphänomene und erforschte die Atmosphäre. Bald fragte er sich, wie Luft, diese Mischung aus den vier Gasen Stickstoff, Sauerstoff, Kohlenstoffdioxid und Wasserdampf eigentlich zusammenhält. Diese Frage klingt heute vielleicht komisch. Damals war jedoch unklar, ob Luft eine instabile chemische Verbindung oder eine Mischung der einzelnen Gase sei. Dalton wusste, dass er kein guter Experimentator war. Also überließ er das Handwerk der exakten Messungen lieber seinen damaligen wissenschaftlichen Kollegen, z.B. die Untersuchung der genauen Zusammensetzung der Atmosphäre an verschiedenen Orten und in verschiedenen Höhen. Der französische Wissenschaftler Joseph Louis Gay-Lussac (1778 – 1850) stieg am 16. September 1804 mit einem Ballon über Paris auf, um eigens auf über 6000 Metern Höhe zwei Luftproben zu nehmen. Diese untersuchte er im Pariser Polytechnikum gemeinsam mit seinem guten Freund Alexander von Humboldt (1769 – 1859). Das Ergebnis: Die Luft war zwar dünner geworden, aber das Verhältnis der Gase blieb konstant. Abschließend stellte Gay-Lussac fest: „Ueberdies haben die Versuche von Cavendish, Macartney, Berthollet und Davy die Identität der Zusammensetzung der atmosphärischen Luft überall an der Oberfläche der Erde dargethan. Man darf daher schließen, daß die Atmosphäre von der Oberfläche der Erde ab, bis zu den größten Höhen, auf welche wir uns erheben können, überall einerlei Beschaffenheit und Zusammensetzung habe.“ [5]
Alexander von Humboldt schreibt in seinem Kosmos: „Das Verhältnis der Stoffe, welche den uns zugänglichen Schichten des Luftkreises angehören, ist seit dem Anfange des neunzehnten Jahrhunderts ein Gegenstand von Untersuchungen gewesen, an denen Gay-Lussac und ich einen thätigen Antheil genommen haben. (…) Nach dieser Analyse enthält die trockene Luft im Volum 20,8 Sauerstoff und 79,2 Stickstoff; dazu 2 bis 5 Zehntausendtheile Kohlensäure, eine noch kleinere Quantität von gekohltem Wasserstoff (Methan, Anmerk. des Autors), …“ [6].
Zurück zu DALTON. Er wusste nun, dass Luft immer die gleiche Zusammensetzung hat. Aber wie konnte es sein, dass das schwere Kohlenstoffdioxid nicht zu Boden sank? Vielleicht sorgten Wind und Wetter für eine innige Durchmischung der leichteren und schwereren Gase untereinander? Oder gab es eine andere Erklärung? DALTON zeichnete die vier Gase in sein Skizzenbuch.
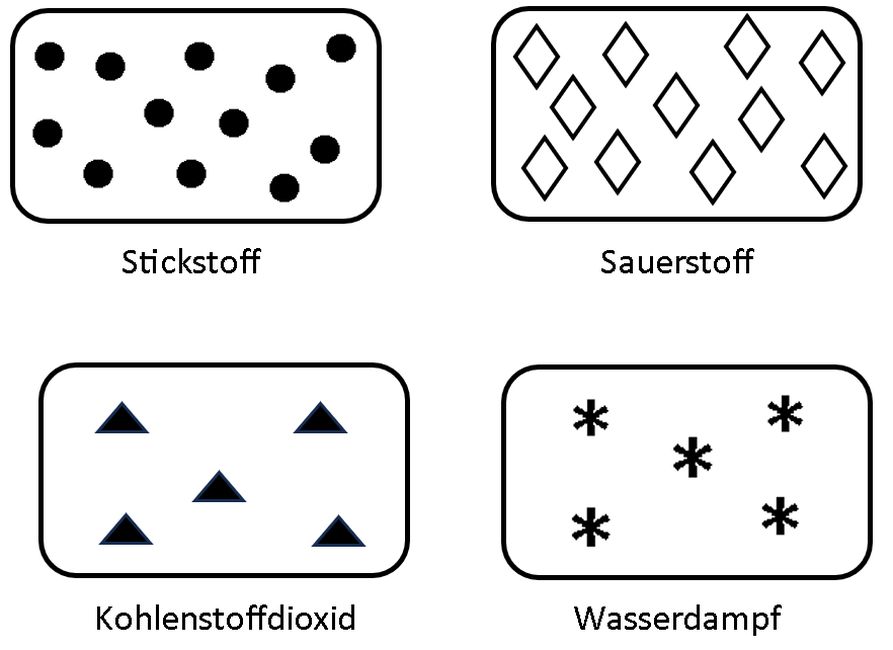
Bild 2: John Dalton skizzierte die Gase der Atmosphäre – Punkte für Stickstoff, Rauten für Sauerstoff, Dreiecke für Kohlenstoffdioxid und Sternchen für Wasserdampf.
(Skizze: Lüttgens)
Anschließend fertigte er eine weitere Skizze an – eine Mischung der Gase. Wenn die zugrundeliegende Idee stimmte, dann mussten die einzelnen Gase aus kleinsten Teilchen bestehen, die sich ständig bewegen, aneinanderstoßen und so für diese ständig Diffusion und damit für ein konstantes Verhältnis der Gase sorgen.
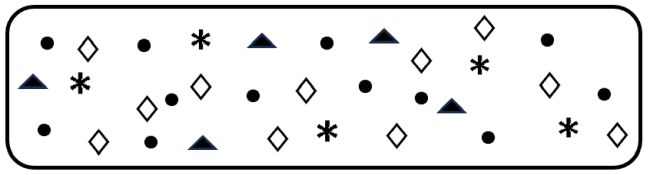
Bild 3: John Daltons Vorstellung der atmosphärischen Gasmischung.
(Skizze: Lüttgens)
Nun herrschte damals eine wissenschaftliche Kontroverse, ob sich in einer Verbindung wie Wasser das Verhältnis seiner Zusammensetzung aus Wasserstoff und Sauerstoff ändern könne, oder ob dieses absolut konstant sei. Uns mag diese Kontroverse heute vielleicht verwundern, jedoch müssen wir bedenken, dass die experimentellen Möglichkeiten im 18. Jahrhundert in keiner Weise mit z.B. heutigen „atomaren Waagen“, den sogenannte Massenspektrometern, vergleichbar sind.
DALTONS Gedanken dazu: „Ob die letzten Theilchen eines Stoffes, wie Wasser, alle gleich sind, d.h. von derselben Gestalt, demselben Gewicht etc. ist eine Frage von einiger Wichtigkeit. Aus dem, was wir wissen, haben wir keinen Grund, eine Verschiedenheit dieser Theile zu vermuten: besteht eine solche im Wasser, so muss sie gleicherweise in den Elementen, welche das Wasser bilden nämlich Wasserstoff und Sauerstoff bestehen. Wären einige Wassertheilchen leichter als andere, und wird ein Theil der Flüssigkeit bei irgend einer Gelegenheit von solchen leichteren Theilchen gebildet, so müssten sie das specifische Gewicht des Wassers beeinflussen, ein Umstand, der nicht bekannt ist.“ [aus 3, S. 15]]
Er schreibt zu Verbindungen wie Wasser „Die chemische Synthese und Analyse geht nicht weiter, als bis zur Trennung der Atome, und ihrer Wiedervereinigung.“

Bild 4: John Daltons Vorstellung der Zusammensetzung von Wasser
(Skizze: Lüttgens)
Mutig behauptete DALTON, dass alle Atome eines Elements gleich groß und gleich schwer seien. Die Atome verschiedener Elemente sollten sich jedoch voneinander unterscheiden in ihrem Volumen und ihrem Gewicht.
Schließlich zeigte der französische Chemiker JOSEPH LOUIS PROUST (1754 – 1826) in aufwändigen Messungen mit den absolut reinsten Substanzen, die damals verfügbar waren, dass sich die Elemente immer in definiertem Verhältnis zueinander in Verbindungen miteinander kombinieren. PROUST formulierte 1799 dieses fundamentale Prinzip der Chemie, das Gesetz der konstanten Proportionen. In heutigen Chemiebüchern liest es sich so: Das Massenverhältnis zweier sich zu einer chemischen Verbindung vereinigender Elemente ist konstant. [7]
Alles ist relativ
DALTON fragte sich anschließend, wie schwer die Atome der verschiedenen Elemente seien. Ihm wurde schließlich klar, dass man das absolute Gewicht gar nicht kennen muss, sondern nur das Verhältnis der Massen der Atome der verschiedenen Elemente zueinander, um weitere chemische Berechnungen durchführen zu können. Er betonte „die Wichtigkeit und den Vortheil der Bestimmung der relativen Gewichte der letzten Theilchen sowohl der einfachen wie der zusammengesetzten Stoffe, die Zahl der einfachen Elementaratome, welche ein zusammengesetztes Atom bilden …“
DALTON formulierte Regeln für Verbindungen. Die einfachste lautete: „Wenn eine Verbindung zweier Stoffe erhalten werden kann, so muss vermuthet werden, dass sie eine binäre ist, wenn nicht ein Grund für das Gegentheil spricht.“ Mit „binär“ ist gemeint, dass zwei Atome eine Verbindung bilden. Er formulierte entsprechende Regeln für ternäre und quartäre Verbindungen aus mehr als zwei Atomen.
Daraus zog DALTON u.a. „folgende Schlüsse: 1) dass Wasser eine binäre Verbindung von Wasserstoff und Sauerstoff ist, und dass die relativen Gewichte der beiden elementaren Atome annähernd 1:7 sind; - 2) dass Ammoniak eine binäre Verbindung von Wasserstoff und Stickstoff mit den relativen Atomgewichten 1:5 ist, …“ usw. [aus: 3, S. 17]
Er fertigte eine Tabelle an – den Schlüssel zur Lösung des Gewichts-Problems. DALTON startete mit dem leichtesten Element Wasserstoff und legte es als Standard mit dem relativen Gewicht 1 fest. Alle anderen Atome der damals bekannten Elemente nahm er als schwerer an.
Mit dem Wissen, dass sich Wasser aus einem Teil Wasserstoff und einem Teil Sauerstoff zusammensetzte, schloss er: „Das Sauerstoffatom hat ein relatives Gewicht von 7. Das Wasseratom hat ein relatives Gewicht von 8.“
1 Atom Wasserstoff + 1 Atom Sauerstoff = 1 Atom Wasser
Auch war damals bekannt, dass Ammoniak aus einem Teil Wasserstoff und fünf Teilen Stickstoff besteht und nach DALTON eine binäre Verbindung ist:
1 Atom Wasserstoff + 1 Atom Stickstoff = 1 Atom Ammoniak
Also musste das relative Gewicht eines Stickstoffatoms 5 sein; das relative Gewicht des „Ammoniakatoms“ war 6. Daraus ergab sich mit den damaligen Stoffkenntnissen die wichtige Tabelle der relativen Gewichte der Atome:
- Wasserstoff; rel. Gewicht 1
- Stickstoff 5
- Kohlenstoff 5
- Sauerstoff 7
- Phosphor 9
- Schwefel 13
- Magnesia 20
- Kalk 23
- Natron 28
- Kali 42
- ...
Eine zweite Entdeckung
DALTON war ebenfalls erstaunt über die Einfachheit der Beziehungen der Atome zueinander innerhalb von chemischen Verbindungen. Die zwei Elemente Kohlenstoff und Sauerstoff, die sich zu Kohlenoxyd (heute Kohlenstoffmonoxid) verbinden, bilden ein Verhältnis 3 : 4. Kohlensäure (heute Kohlenstoffdioxid): Hier verbinden sich die Elemente im Verhältnis 3 : 8. Die Erkenntnis daraus: Kohlenoxyd mit dem relativen Gewicht von 12 musste aus einem Atom Kohlenstoff und einem Atom Sauerstoff bestehen, Kohlensäure mit dem Gewicht von 19 aus einem Atom Kohlenstoff und zwei Atomen Sauerstoff. Er fertigte auch dazu eine Skizze an.

Bild 5: John Daltons Vorstellung der Zusammensetzung von Kohlenstoffmonoxid (li.) und Kohlenstoffdioxid (re.)
(Skizze: Lüttgens)
1803 formulierte DALTON das Gesetz der multiplen Proportionen, das heute so formuliert wird: Die Massenverhältnisse zweier sich zu verschiedenen chemischen Verbindungen vereinigender Elemente stehen im Verhältnis einfacher ganzer Zahlen zueinander. [7]
Zu guter Letzt
Schülerinnen und Schülern wird im Anfangsunterricht gesagt, dass sich die Masse eines Atoms mit keiner noch so genauen Waage bestimmen lasse. Im Chemiebuch heißt es dann rasch: Ein Wasserstoffatom wiegt nur 0,000 000 000 000 000 000 000 001 674 g. Wirklich eine nicht vorstellbar kleine Masse, oder? Wissbegierigen Kindern wird mitgeteilt, dass dies nur mit einer speziellen physikalischen Maschine, dem anfangs in diesem Artikel bereits erwähnten Massenspektrometer, bestimmt werden könne – ohne zu sagen, wie dieses Gerät eigentlich funktioniert.
Anschließend wird die atomare Masseneinheit unit – kurz u – eingeführt. Diese Einheit geht, wie wir nun wissen, auf DALTON zurück. Das Wasserstoffatom ist das leichteste unter den Atomen aller Elemente und wiegt ungefähr eine Einheit, also 1 Unit – also kurz: 1 u.
„Ein Massenspektrometer hatte Dalton wohl kaum,“ sagte eine pfiffige Schülerin neulich in meinem Chemieunterricht. Nun, da wir diesen Tipp gelesen haben, können wir, wenn es um die Welt der Atome geht und um die Frage, wie schwer diese kleinsten, unteilbaren Teilchen sind und wie DALTON darauf gekommen ist, nicht nur nachvollziehen, dass experimentelle Ergebnisse und mutige Annahmen DALTONS zum Atommodell und zur Bestimmung der relativen Masse von Atomen führten. Wir können diese spannende chemiehistorische Geschichte vielleicht auch lebendig werden lassen in unserem Chemieunterricht.
Literatur:
[1] Vgl. Ciceros Ausspruch „Hic Abdera“ in: Epistulae ad Atticum, 4,16,6 mit der Bedeutung „Hier ist die Dummheit zuhause“, zitiert nach WIKIPEDIA (zuletzt abgerufen am 5.2.2024)
[2] Wilhelm Capelle: Die Vorsokratiker, Leipzig 1935, S. 399., zitiert nach WIKIPEDIA (zuletzt abgerufen am 5.2.2024)
[3] John Dalton: A new system of chemical philosophy, in: Ostwald´s Klassiker der exacten Wissenschaften, Nr. 3 Die Grundlagen der Atomtheorie, Verlag von Wilhelm Engelmann, Leipzig 1889, https://digbib.bibliothek.kit.edu/volltexte/digital/1/277.pdf (zuletzt abgerufen am 5.2.2024)
[4] Crucibles, The story of chemistry, Bernard Jaffe, 4. Ausgabe, Dover Publications Inc., New York 1976
[5] Geschichte der atmosphärischen Chemie des Sauerstoffs, Detlev Möller (Berlin, MLS), Veröffentlicht: 1. Juni 2023, Leibniz Online, Nr. 49 (2023), Zeitschrift der Leibniz-Sozietät der Wissenschaften zu Berlin e. V., ISSN 1863-3285 • DOI: 10.53201/LEIBNIZONLINE49 (zuletzt abgerufen am 5.2.2024)
[6] Alexander von Humboldt: Kosmos, Entwurf einer physischen Weltbeschreibung, Die Andere Bibliothek, Berlin 2014, S. 163
[7] Hollemann Wiberg; Lehrbuch der anorganischen Chemie, 102. Auflage, de Gruyer, Berlin 2007, S.18 f.
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 18. März 2024, Fritz Franzke