Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Juni 2024 (Tipp-Nr. 323)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Uwe Lüttgens
Bild 1: Bouldern ist ein Trendsport
Bouldern? Das ist eine Spielart im Klettersport. Boulderhallen, in denen diese Form des Kletterns, bei der ohne Sicherungsmaßnahmen, also ohne Seil und Gurt, bis zu einer Kletterhöhe von drei bis vier Metern geklettert wird, erfreuen sich großer Beliebtheit. Es gibt sie in fast jeder größeren Stadt. Jeder kann sofort loslegen, egal ob Gelegenheitskletterer, Profi oder Anfängerin, weil keine aufwändigen Sicherungsmaßnahmen notwendig sind, um Abstürze zu vermeiden. Bild 2: Kletterausrüstung für´s Bouldern: Schuhe und Chalk
Viel braucht es nicht zum Bouldern. Kletterschuhe und ein Chalkbag, also einen Beutel mit einem weißem Pulver für die Hände, und schon kann´s los gehen. Die Kletterschuhe sorgen für die notwendige Reibung auf den Tritten und das Chalk für trockene Hände und damit für bessere Haftung an den Griffen. Bild 3: Vor dem Bouldern wird „gechalkt“, damit die Hände besser an den Griffen haften.
„Dank feinstem Magnesiumcarbonat werden die Reibungswerte erhöht und man läuft zu Höchstleistungen auf!“ [1a], „Maximale Haftung und hervorragende Schweißabsorption sind mit dem hochwertigen und feinen Magnesiumcarbonat vorprogrammiert.“ [1b] So oder ähnlich heißt es in der Werbung für dieses besondere, bei Kletterinnen und Kletterern so beliebte weiße, leistungssteigernde Zauberpulver. Prüfen wir zu Beginn die Aufnahmefähigkeit von Schweiß. Wir nehmen hierfür Wasser als Modellsubstanz in diesem ersten Versuch. Versuch 1: Wasser und Chalk Geräte und Chemikalien: Petrischale (dreigeteilt), Spatel, Chalk (basisches Magnesiumcarbonat), Wasser Durchführung: In eine dreigeteilte Petrischale wird jeweils eine Spatelspitze Chalk gegeben und mit unterschiedlichen Mengen Wasser versetzt, z.B. 0,5 ml, 1 ml und 2 ml. Anschließend wird nach dem Aufquellen mit dem Spatel leicht verrührt. Bild 4: Chalk nimmt Wasser auf.
Ergebnis: Chalk ist in der Lage, in begrenztem Umfang Wasser aufzunehmen.

(Foto: Lüttgens)
(Foto: Lüttgens)
Was ist Chalk?
In gut besuchten Boulderhallen staubt es gehörig, besonders an den Wochenenden oder in den Abendstunden. Vor jeder Route, vor jedem Kletterversuch werden die Hände „gechalkt“. Häufig wird das feine, weiße Pulver dabei viel zu dick auf die Finger aufgetragen – aus Unwissenheit oder Nervosität. Denn für einen optimalen Gripp reicht eine dünne Schicht aus, mehr von dem weißen Pulver ist da eher kontraproduktiv.
(Foto: Lüttgens)

(Foto: Lüttgens)
Was ist nun Chalk? Fragt man Kletterinnen und Kletterer danach, wird nicht so selten gesagt, es handele sich um Magnesium. Das feine weiße Pulver kann jedoch, wie jeder leicht sieht, kein Metall sein. Es fehlt schließlich jeglicher metallische Glanz auf dem feinen weißen Pulver, das man sich auf die Hände schmiert, bevor eine neue Kletterroute angegangen wird. Dann wird meist korrekter geantwortet, dass es sich um Magnesia handele. Das ist ein Salz der Kohlensäure, bei dem das Element Magnesium beteiligt ist. Chemisch gesehen handelt es sich um Magnesiumcarbonat. Aber Vorsicht! Es kann sich nicht um MgCO3 handeln, wie man meinen könnte. Der Blick auf eine Nachfüllpackung für mein Chalkbag klärt auf.

Bild 5: Die Zusammensetzung des weißen Pulvers wird manchmal auf der Rückseite einer Packung Chalk angegeben.
(Foto: Lüttgens)
Der Blick auf den Inhaltstoff offenbart: Es handelt sich laut Herstellerangaben um Magnesiumhydoxidcarbonat. Und tatsächlich offenbaren sich die Hydroxid-Ionen sofort im zweiten Versuch.
|
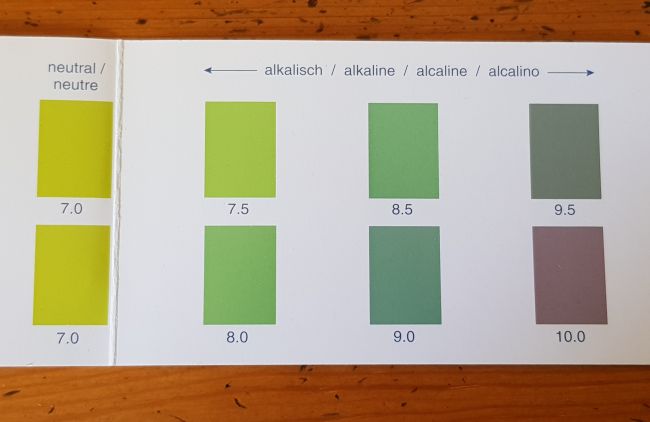
Versuch 2: pH-Wert von Chalk Geräte und Chemikalien: Reagenzglas, Spatel, Chalk (basisches Magnesiumcarbonat), Wasser, Universalindikator Durchführung: In ein Reagenzglas wird eine Spatelspitze Chalk gegeben. Mit Wasser aufgefüllt wird das Reagenzglas nach Zugabe von zwei bis drei Tropfen Universalindikator kurz geschüttelt. Der pH-Wert der milchig trüben Suspension wird überprüft.
Bild 6: Der pH-Wert von Chalk liegt im Bereich von pH 9
Ergebnis: Chalk reagiert deutlich alkalisch. |
Etwas Chemie: Reines Magnesiumcarbonat gibt es in der Natur als Magnesit mit der Formel MgCO3. Es reagiert in wässriger Lösung neutral. Weitere kristallwasserhaltige Minerale sind Barringtonit MgCO3 · 2 H2O, Nesquehonit MgCO3 · 3 H2O und Lansfordit MgCO3 · 3 H2O. Gibt man das schwer lösliche Magnesiumcarbonat in Wasser, kann es nach folgender Gleichung reagieren:
5 MgCO3 + 5 H2O → 4 MgCO3 · Mg(OH)2 · 4 H2O + CO2
Es bildet sich basisches Magnesiumhydroxycarbonat 4 MgCO3 · Mg(OH)2 · 4 H2O. In dessen Kristallgitter sind neben Magnesium-Ionen Mg2+ und Carbonat-Ionen CO32- auch Hydroxid-Ionen OH- und Wassermoleküle H2O eingebaut. Das feine, weiße Pulver findet nicht nur als Chalk in Kletterhallen Verwendung; es wird als Magnesia alba (lat. alba weiß) beispielsweise in der Medizin zur schonenden Neutralisation von Magensäure eingesetzt.
Wie wirken sich die in das Kristallgitter des Magnesiumcarbonats zusätzlich eingebauten Hydroxid-Ionen und Wassermoleküle aus? In einem letzten Versuch vergleichen wir die Dichte von Chalk mit der von Magnesiumcarbonat.
|
Versuch 3: Dichte von Chalk Geräte und Chemikalien: kleines Becherglas, Spatel, Waage, Chalk (basisches Magnesiumcarbonat) Durchführung: Das Volumen des feinen weißen Pulvers wird in einem kleinen Becherglas gemessen, anschließend gewogen und aus dem Verhältnis von Masse zu Volumen die Dichte bestimmt.
Bild 7: In einem kleinen Messbecher lässt sich das Volumen gut bestimmen.
Ergebnis: 20 ml Chalk wiegen 2,35 g. Daraus ergibt sich eine Dichte von ca. 0,12 g/cm3. |
Vergleichen wir unser Ergebnis mit der tabellierten Dichte von Magnesiumcarbonat von 2,96 g/cm3 [2], dann wird sofort deutlich, dass sich die Umstrukturierung des Kristallgitters erhebliche Auswirkungen hat: Die Dichte nimmt deutlich um eine Größenordnung ab. Aus dem klumpigen festen Magnesiumcarbonat ist das in der Kletterszene beliebte weiße, leistungssteigernde Zauberpulver entstanden.
Wie sieht´s in Bouldernhallen mit der Gefährdung durch Chalk aus?
Gemeint ist nicht das Risiko eines Bodensturzes, weil man seine Hände nicht gechalkt hat. Das ist beim Bouldern zwar hoch. Und bei diesen Boulderunfällen kommt es nicht so selten zu Verletzungen; Abschürfungen der Haut, Verrenkungen der Schulter oder auch Brüche von Beinen und Armen gehören bei diesem Sport dazu. Der Autor weiß aus eigener schmerzhafter Erfahrung, wovon er redet.

Bild 8: Staubentwicklung beim Chalken
(Foto: Lüttgens)
Gemeint ist vielmehr die Feinstaubbelastung. Sehr wichtig nicht nur für Menschen mit Problemen mit ihren Atemwegen. Häufig und gerade dann, wenn die Boulderhallen abends oder an Wochenenden mit motivierten Sporttreibenden gut gefüllt sind, kann die Feinstaubbelastung die Konzentration von staubbelasteten Industriehallen übersteigen, wie Untersuchungen gezeigt haben. [3] Die Betreiber von Kletterhallen stellen daher häufig Luftfilteranlagen auf, die die Belastung durch Feinstaub reduzieren. Gut so!

Bild 9: Luftfilteranlage in Berta Block
(Foto: Lüttgens)
Wenn Sie selbst Bouldern gehen, schauen Sie doch mal an die Decke der Boulderhalle Ihres Vertrauens, ob Sie dort eine Absaugung oder einen Luftfilter entdecken. Und Sie selbst können die Staubbelastung minimieren, indem Sie kein offenes Chalk verwenden. – dann nehmen Sie besser einen Chalkball, bei dem das Chalk durch ein feines Netz dosierter abgegeben wird im Vergleich zu losem Chalk. Noch besser ist Liquid Chalk. Wie der Name schon sagt, handelt es sich dabei um Magnesia, das flüssig auf die Hand aufgetragen wird und antrocknet. Probieren Sie´s mal aus.
Literatur:
[1a] https://www.bergfreunde.de/mammut-chalk-powder-chalk (zuletzt abgerufen am 15.5.2024)
[1a] https://www.bergfreunde.de/metolius-super-chalk-chalk (zuletzt abgerufen am 15.5.2024)
[2] GESTIS-Stoffdatenbank; https://gestis.dguv.de/data?name=002610 (zuletzt abgerufen am 15.5.2024)
[3] https://www.zeitschrift-sportmedizin.de/feinstaubbelastung-beim-bouldern-und-sportklettern (zuletzt abgerufen am 15.5.2024)
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 10. Juni 2024, Fritz Franzke