Prof. Blumes Bildungsserver für Chemie
Tipp des Monats Dezember 2024 (Tipp-Nr. 327)
Beim Experimentieren den Allgemeinen
Warnhinweis
unbedingt beachten.
Pipetten-Elektrolyseur und „Knallschaum“-Probe
Uwe Lüttgens
„Wasser ist eine chemische Verbindung, die sich in die Elemente Wasserstoff und Sauerstoff zerlegen
lässt (Analyse), und sie kann aus diesen wieder gebildet werden (Synthese).“ [1]. So weit so
richtig. Mit der Frage danach, wie man zu dieser Aussage gelangt und wie sich die Formel von Wasser mit
einfach und preiswert experimentell ermitteln lässt, möchten sich dieser und zwei folgende Tipps
beschäftigen. Mehrere Forschungsfragen können im Chemieunterricht gestellt werden:
Ein paar Vorbemerkungen
Nach den wichtigen Gasen Wasserstoff, Sauerstoff und Kohlenstoffdioxid wird im Anfangsunterricht im
Themenfeld Wasser neben den Eigenschaften von Wasser auch seine Formel H2O eingeführt.
Nun sollte auf experimentellem Wege der Erkenntnisgewinn folgen, dass es sich bei Wasser nicht um ein Element, sondern um eine chemische Verbindung handelt. Nur: Der Hofmann´sche Zersetzungsapparat und das Eudiometer – mit dieser Apparatur werden die genauen Volumenverhältnisse explosiv reagierender Gasmischungen ermittelt werden – sind beides Gerätschaften für Lehrerdemonstrationsversuche. Sie sind nicht preiswert und der Umgang mit ihnen verlangt experimentelle Erfahrung und Geschick, vielleicht auch ein wenig Mut.
Möglicherweise finden sie deshalb immer seltener den Weg in den Chemieraum. Die meisten Schülerinnen und Schüler kennen beide Apparaturen jedenfalls nicht, viele Referendarinnen und Referendare ebenfalls nicht. Man könnte auch fragen: Wozu auch? Denn beide Apparaturen werden in der Regel genau einmal eingesetzt, nämlich genau bei dieser Fragestellung. Folglich finden sich im Chemiebuch trotz einer namentlichen Erwähnung der Geräte im Text weder Abbildungen noch die Funktion klärende Hinweise (vgl. u.a. [1]). Was also tun? Einfach den neugierigen Schülerinnen und Schülern die Formel mitteilen kann ja kaum die Lösung sein in einem problemorientierten Chemieunterricht, in dem viel experimentiert werden sollte.
Victor Obendrauf, ein engagierter Chemiedidaktiker und geschickter Experimentator stellte vor vielen Jahrzehnten fest: „In Relation zur didaktischen Bedeutung der Wasserzersetzung zur Charakterisierung von fundamentalen Begriffen wie Verbindung, chemische Reaktion, Element und den verstärkten Bestrebungen der Selbsttätigkeit von Lernenden zum Durchbruch zu verhelfen, gibt es in der Literatur relativ wenig Vorschläge, die Wasserelektrolyse auch als Schülerversuch anzulegen.“ [2]
Nun gibt es - auch dank der Pionierarbeit von Victor Obendrauf – experimentelle Vorschläge, wie beides, sowohl die elektrische Zerlegung einschließlich Knallgasprobe [vgl. u.a. 3, 4, 5] als auch die Bildung von Wasser, in Low-Cost-Apparaturen selbst durchgeführt werden können. Allerdings sind diese teilweise schon älteren Anleitung teilweise gut versteckt und nicht immer leicht zu finden. Es gilt jedoch, den experimentellen Schatz zu heben. Denn ich bin mir sicher: Unsere Lerngruppen werden es durch ihre Begeisterung für den experimentellen Erkenntnisweg im Chemie-Anfangsunterricht danken.
In diesem und den folgenden Tipps möchte ich daher den Weg zur Formel von Wasser nochmals schrittweise skizzieren, bei dem die Schülerinnen und Schüler ihre experimentellen Fähigkeiten im Umgang mit möglicherweise bereits im Themenfeld Gase genutzter Medizinspritzentechnik ausbauen können, Planungskompetenz entwickelt werden, das Ergebnis einer Versuchsreihe zu den Volumenverhältnissen von Wasserstoff und Sauerstoff bei der quantitativen Analyse vorausgesagt werden und schließlich davon ausgehend die Formel von Wasser durch „Rumprobieren“ gefunden werden kann.
Low-Cost-Elektrolyse mit Knallschaum-Probe
Der Schülerversuch besteht aus zwei Teilen: Durch elektrolytische Zersetzung des Wassers wird der
Pipettenkopf mit Knallgas gefüllt. Anschließend wird das Knallgas aus dem Pipettenkopf in eine Seifenlösung
gedrückt und der „Knallschaum“ dort mit einem Streichholz oder Glimmspann entzündet. [vgl. u.a. 3, 4, 5]
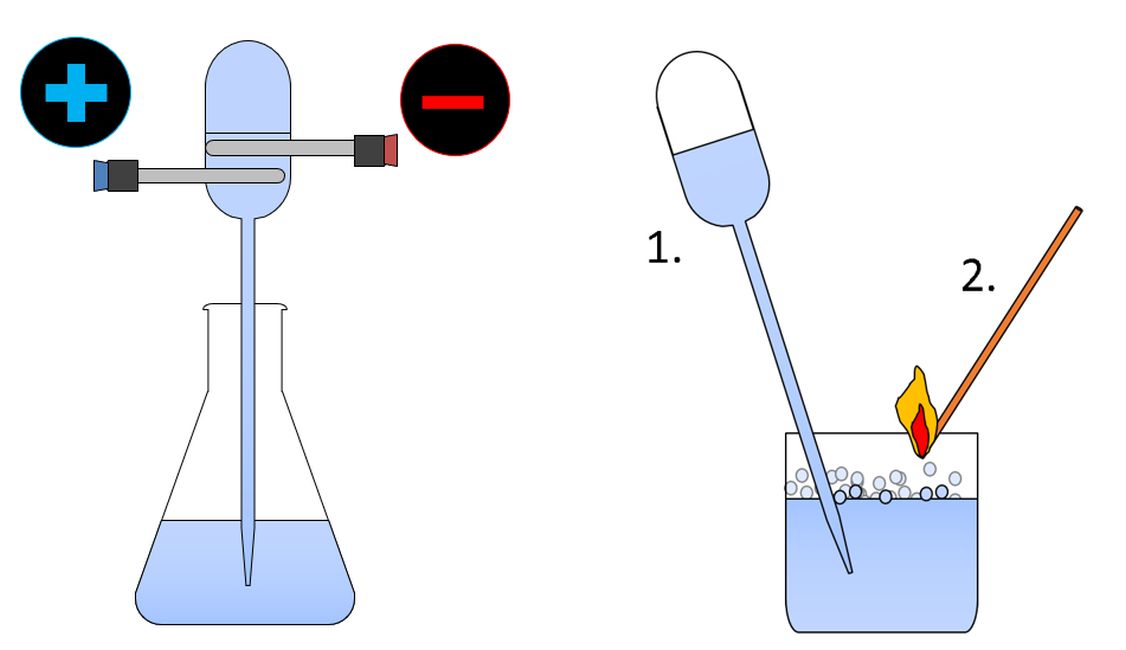
Skizze 1: Die qualitative Analyse von Wasser besteht aus zwei Versuchen, die anhand der
beiden Skizzen protokolliert werden können.
(Skizze: Lüttgens)
Elektrolytische Zersetzung von Wasser in der Pipette
|
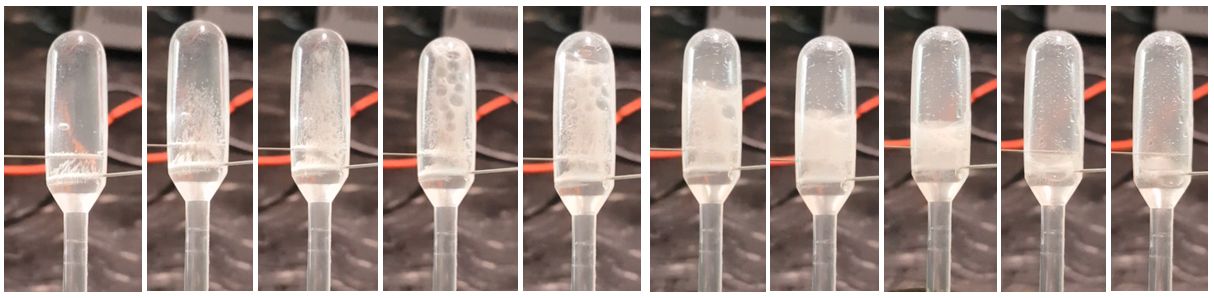
Experiment 1: Elektrolytische Zersetzung von Wasser in der Pipette Material: Natriumcarbonat-Lösung (ca. 20 g / 100 ml), Einmalpipette 1 ml, 2 Stecknadeln, kleines Becherglas, 2 Kabel mit Krokodilklemmen, 9-Volt-Blockbatterie Durchführung: Die mit der gesättigten Waschsodalösung komplett gefüllte Pipette wird entsprechend der Skizze mit zwei Stecknadeln als Elektroden präpariert und mit der Batterie über die beiden Kabel elektrisch leitend verbunden (Bild 1). Beobachtung: An den beiden Stecknadel-Elektroden setzt deutlich die Gasentwicklung ein. Erreicht das Knallgasgemisch die beiden Elektroden im unteren Teil des Pipettenkopfes, stoppt die Gasentwicklung.
Bild 1: Im Pipettenkopf ist die Gasentwicklung bei der elektrolytischen
Zersetzung von Wasser deutlich zu erkennen.
Ergebnis: Der Pipettenkopf ist komplett durch die Elektrolyse mit einem Knallgasgemisch befüllt. |
Klick mich an!
Bild 2: Die Gasentwicklung bei der elektrolytischen Zersetzung von Wasser ist im
Pipettenkopf deutlich zu erkennen.
(Foto: Lüttgens)
Einige Tipps zum Experiment:
- Verwenden Sie Pipetten mit einem Volumen von 1 ml. Bei größeren Volumina gelingt die Überführung des gebildeten Knallgases in ein Becherglas im Seifenlösung für den „Knallschaum“ nicht wirklich gut.
- Es verlangt ein wenig Geschick, den Pipettenkopf vor der Elektrolyse komplett mit Wasser zu füllen.
Zwei
Tipps helfen weiter. Zum einen sollte die restliche Luft kraftvoll in das Wasser im Erlenmeyerkolben
oder
das Becherglas gedrückt werden. Zum anderen kann die Schwerkraft ein wenig helfen, wenn zuvor die
Pipette
so abgeknickt wurde, dass sich der Kopf mit Wasser gefüllt hat und die überschüssige Luft dann
entfernt
wird.

Bild 3: Mit ein wenig Geschick kann die Luft schrittweise aus dem Pipettenkopf entfernt werden.
(Foto: Lüttgens) - Bei der Auswahl der Stecknadeln ist darauf zu achten, dass diese aus Edelstahl bestehen und nicht
mit
einer zu dünnen Nickelschicht überzogen sind. Ansonsten wird die Oberfläche korrodiert und es bilden
sich
je nach Elektrolytlösung unschöne, die Elektrolyse behindernde bräunlich rote oder grünlich Schlieren,
die
auf Eisen- und möglicherweise auch Nickelionen zurückzuführen sind. Auch zeigen sich dann deutliche
Korrosionsspuren an der aufgerauten Oberfläche der Stecknadeln.

Bild 4: An den Stecknadeln bildet sich Rost, wenn mit Schwefelsäure als Elektrolyt gearbeitet wird.
(Foto: Lüttgens) - Die gewissenhafte und erfolgreiche Durchführung beider Experimente wird mit einem deutlich hörbaren
Pfiff oder Knall belohnt, der als Bestätigung von der Lehrperson dokumentiert werden kann. Damit kann
das
experimentelle Geschick der Schülerinnen und Schüler bewertet werden.
Klick mich an!
Bild 5: Die Knallgasreaktion gelingt auch mit wenig Schaum erfolgreich.
(Foto: Lüttgens)
|
Experiment 2: „Knallschaum“-Probe Material: Einmalpipette 1 ml, gefüllt mit Knallgasgemisch aus Experiment 1, kleines Becherglas mit Seifenlösung, Streichhölzer oder Feuerzeug Durchführung: Das Knallgasgemisch wird aus dem Pipettenkopf in die Seifenlösung so gepresst, dass dort an der Oberfläche ein Schaum aus mit Knallgas gefüllten Seifenblasen entsteht. (s. Bild 6). Anschließend wird eine Flamme an den Seifenschaum geführt. Beobachtung: Das Knallgasgemisch entzündet sich mit einem deutlich wahrnehmbaren Knall.
Bild 6: Der erzeugte „Knallschaum“ kann entzündet werden
Ergebnis: Die Knallgasprobe verläuft positiv. |
Für Spezialisten
Als Elektrolytlösung wird eine gesättigte Waschsodalösung verwendet. Diese sorgt für eine basische
Lösung.

Bild 7: Bei sogenanntem kalziniertem Soda handelt es sich feinkristallines,
kristallwasserfreies Natriumcarbonat Na2CO3. Im Supermarkt wird es als Waschsoda
gekauft.
(Foto: Lüttgens)

Bild 8: Natriumcarbonat reagiert stark alkalisch.
(Foto: Lüttgens)
Folgende Reaktion kann für den exothermen Lösungsvorgang formuliert werden:
CO32- (aq.) + H2O (l) → HCO3- (aq.) + OH- (aq.)
Aufgrund des basischen Milieus der Elektrolyt-Lösung laufen folgende Reaktionen an den beiden Elektroden ab:
Reduktion an der Kathode (Minuspol):
2 H2O (l) + 2 e- → H2 (g) + 2 OH- (aq.)
Ered = -0,83 V
Oxidation an der Anode (Pluspol):
2 OH- (aq.) → ½ O2 (g) + H2O (l) + 2 e-
Eox = 0,40 V
Gesamt-RedOx-Reaktion:
H2O (l) + 2 OH- (aq.) → H2 (g) + ½ O2 (g) + 2 OH- (aq.)
Letztlich läuft allein die Zersetzung von Wasser in Wasserstoff und Sauerstoff ab:
H2O (l) → H2 (g) + ½ O2 (g)
Die Zersetzungsspannung U ergibt sich theoretisch aus den formulierten RedOx-Paaren:
U = Eox - Ered = 0,40 V – (-0,83 V) = 1,23 V
In der Praxis müssen jedoch deutlich höhere Spannungen angelegt werden, damit sich die beiden Gase Wasserstoff und Sauerstoff in nennenswertem Umfang an den beiden Elektroden entwickeln. Das liegt an einer Hemmung der Reaktionen an den Elektrodenoberflächen, weshalb zur Bildung der Gase zusätzliche Energie erforderlich wird, die der Grund der notwendigen Überspannung von einigen Volt sind. Die 9 Volt der Blockbatterie reichen jedoch bei weitem aus.
Zu guter Letzt
Wenn Sie nicht wissen, an welcher Elektrode welche Vorgänge bei der Elektrolyse
ablaufen, dann hilft die kleine Eselbrücke OPA: Oxidation –
Pluspol – Anode. Bei galvanischen Zellen, die
elektrische Energie freisetzen, merken Sie sich als Eselsbrücke die OMA:
Oxidation – Minuspol – Anode.
Literatur:
[1] FOKUS Chemie 78 Berlin, Cornelsen Schulverlag, Berlin 20216, S. 111
[2] R. Kickuth, R. Stephani (Hrsg. ), Victor Obendraufs schöne Experimente, Band 1, Agentur und Verlag
Rubikon Rolf Kickuth, Gaiberg 2015, Die Wasserzerlegung im Schülerversuch, S. 81
[3] Chemie? – Aber sicher!, Akademiebericht 475, 4. Aufl., Akademie für Lehrerfortbildung und
Personalführung (ALP), Dillingen 2014, 06-24 Elektrolyse von Wasser – Microscale-Variante für
Schülerübungen
[4] K. Häusler, H. Rampf, R. Reichelt, Experimente für den Chemieunterricht, Oldenbourg Schulverlag, 2.
Aufl., München 1991, 11.3 Knallgas aus Wasserstoff und Sauerstoff, S. 96
[5] Chemie heute 7/8 Berlin/Brandenburg, Schroedel – Bildungshaus Schulbuchverlage, Braunschweig 2016,
S. 114, Versuch 1: Elektrolyse – Wasserzerlegung mit Strom Teil 1
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 8. Dezember 2024, Fritz Franzke