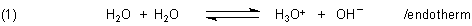
Ist heißes Wasser saurer als kaltes?
Eine Frage, die man immer wieder gestellt bekommt: Wenn Wasser erhitzt wird, nimmt sein Ionenprodukt zu. Das heißt, dass es mehr Protonen gibt. Also muss das Wasser doch sauer werden.
Darüber haben sich in den 1960er Jahren Wissenschaftler ernsthaft gestritten.
Der Grund ist, dass die Eigendissoziation des Wassers endotherm und somit temperaturabhängig ist.
Die Energie beträgt 56,61 kJ/mol.
Durch Temperaturerhöhung verschiebt man das Dissoziationsgleichgewicht des Wassers deshalb auf die rechte Seite, das heißt, dass die Ionenkonzentrationen zunehmen. Damit vergrößert sich auch der Wert des Ionenprodukts KW.

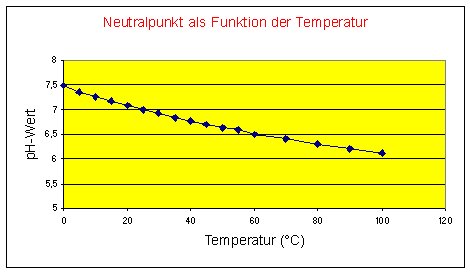
Die folgende Tabelle zeigt das Ionenprodukt des Wassers bei verschiedenen Temperaturen. Daraus
berechnen wir auch gleich noch die Konzentrationen (Aktivität) der Hydrogenium-Ionen am Neutralpunkt sowie den jeweils
zugehörigen pH-Wert. Am Neutralpunkt gilt [H+] = [OH-]. Eingesetzt in (2) folgt damit:

| Temperatur (°C) |
0 | 10 | 20 | 25 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
| Ionenprodukt KW · 1014 |
0,11 | 0,29 | 0,68 | 1,00 | 1,47 | 2,92 | 5,47 | 9,61 | 15,88 | 21,37 | 37,82 | 54,57 |
| Protonenkonzentration (-Aktivität) [H+] · 107 |
0,33 | 0,54 | 0,82 | 1,00 | 1,21 | 1,71 | 2,34 | 3,10 | 3,98 | 4,62 | 6,15 | 7,39 |
| pH-Wert am Neutralpunkt |
7,48 | 7,27 | 7,08 | 7,00 | 6,92 | 6,77 | 6,63 | 6,51 | 6,40 | 6,30 | 6,21 | 6,13 |
Wir entnehmen der Tabelle, dass der pH-Wert am Neutralpunkt ebenfalls temperaturabhängig ist. Von 0 bis 100 °C nimmt er um 1,35 Einheiten ab.
Genau genommen stimmt das mit dem pH-Wert 7,000 exakt für 22 °C.
| Temperatur (°C) |
20 | 22 | 25 |
| Ionenprodukt KW · 1014 |
0,6815 | 1,000 | 1,008 |
| Protonenkonzentration (-Aktivität) [H+] · 107 |
0,8255 | 1,000 | 1,004 |
| pH-Wert am Neutralpunkt |
7,083 | 7,000 | 6,998 |
Aber das spielt im Alltag keine Rolle, weil drei Stellen bei der pH-Wertmessung sowieso
unrealistisch sind und man sich international auf die Standardtemperatur 25 °C (298,16 K) geeinigt hat.
Merken wir uns also:
| Bei 25 °C ist der Neutralpunkt des Wassers pH 7. |
Dass sich der Neutralpunkt bei Erwärmung des Wassers scheinbar ins Saure verschiebt, ist natürlich kein
Zeichen für Saurerwerden, denn auch hier sind immer genau so viele Protonen wie Hydroxid-Ionen
vorhanden. Das Wasser ist weder sauer noch seifig/alkalisch geworden, sondern immer neutral geblieben.
Bei höheren oder tieferen Temperaturen gilt also eine andere Definition für Neutral.
Das alles ist nicht nur im Schullabor experimentell schwer nachzuprüfen, weil alle zugänglichen Systeme (Wasser, Puffer) selbst temperaturabhängig sind.
Wenn man allerdings Messmethoden anwendet, die nur auf die Protonenkonzentration (besser: Aktivität) ansprechen - wie die potentiometrische pH-Wertbestimmung mit einer Glaselektrode, so nimmt der pH-Wert des Neutralpunkts scheinbar ab. Heißes Wasser scheint für ein pH-Meter sauer zu sein. Das war letztlich auch die Ursache des Gelehrtenstreits.
Aus diesem Grunde hat man bei pH-Metern immer eine Temperaturkorrektur vorzunehmen.
Das gilt auch für den Umschlagsbereich von Säure/Base-Indikatoren.
Und wie steht es mit dem Geschmack „Sauer“, der ja ebenfalls von der Protonenkonzentration abhängt? Man kann die kleinen Unterschiede im mittleren Temperaturbereich kaum feststellen. Und zu heiße oder zu kalte Suppen wird wohl keiner daraufhin prüfen.
Weitere Texte zum Thema „Wasser“