
Die Aggregatzustände des Wassers
Alle Stoffe treten in mindestens drei Aggregatzuständen auf: Fest - Flüssig - Gasförmig. So gibt es den Stoff H2O als festes Eis, flüssiges Wasser und als Wasserdampf. Letzterer ist genaugenommen ein Gas. Wenn wir den Dampf sehen, so ist es eigentlich kondensiertes flüssiges Wasser, das aus feinsten Tröpfchen besteht. In der Technik spricht man von Nassdampf.

Bild 1: Die drei Aggregatzustände des Wassers
(Fotos: Blume)
Eis, Wasser und Dampf sind Phasen des Wassers. Phasen sind homogene (d. h.
im Aggregatzustand einheitliche) Abschnitte der Materie, die durch Grenzschichten getrennt sind.
Eis, Wasser und Wasserdampf sind drei Phasen eines einzigen chemischen Stoffs: H2O. Sie liegen stets nebeneinander vor. Eis ist stets mit einem Film von flüssigem Wasser überzogen. Das flüssige Wasser verdampft (wie auch das Eis; davon unten mehr).
Im festen Zustand sind die Teilchen hochgeordnet, z. B. in einem Kristallgitter, in der Flüssigkeit ist die Ordnung geringer, die Teilchen hängen aber noch zusammen. In der Gasform bewegen sich alle Teilchen mehr oder weniger unbeeinflusst. Wir sehen, dass wir zur Änderung der Aggregatzustände Energie zuführen oder abführen müssen.
Bild 2 zeigt den Zusammenhang zwischen Aggregatzustand und Energiezufuhr.
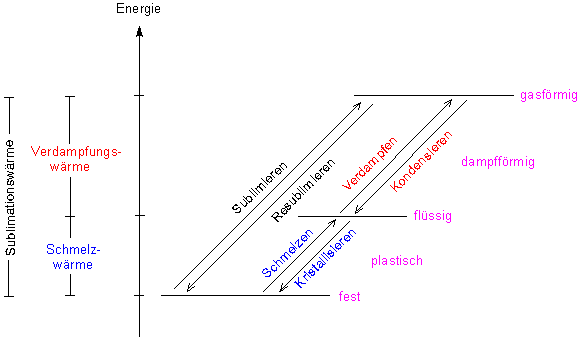
Bild 2: Aggregatzustände (schematisch)
Wir sehen, dass es Zustandsänderungen gibt. Man spricht auch von Phasenübergängen.
Hier sind die Energiewerte für die Phasenübergänge des Wassers. Die Vorzeichen beziehen sich auf das System, das seine Zustände ändert.
| Energieform | Energie (kJoule/kg) | Energie (kJoule/mol) |
| Schmelzwärme | 334,4 | 6,01 |
| Kristallisationswärme | -334,4 | -6,01 |
| Verdampfungswärme | 2261,8 | 40,67 |
| Kristallisationswärme | -2261,8 | -40,67 |
| Sublimationswärme | 2596,2 | 46,69 |
| Resublimationswärme | -2596,2 | -46,69 |
Jeder Zustandswechsel (Phasenübergang) ist durch ein bestimmtes Wertepaar von Druck und Temperatur
charakterisiert. Da diese Werte extrem reproduzierbar sind, dienen sie auch zur Eichung von Thermometern
(z. B. Celsius-Skala). So liegt der Schmelzpunkt von Eis bei 0 °C, der Siedepunkt von Wasser bei 100 °C
(jeweils bei Normaldruck).
Der direkte Übergang Fest -> Gasförmig heißt Sublimation. Er spielt eine wichtige Rolle beim Verdunsten von Eis. So trocknet Wäsche im Winter. Technisch macht man sich das bei der Gefriertrocknung zunutze. Der umgekehrte Vorgang, die Resublimation, ist die direkte Bildung von Eis aus Wasserdampf. Das beobachtet man bei der Raureifbildung.
Zwischen den Zuständen Fest und Flüssig befindet sich der plastische Übergangszustand, der nicht durch scharfe Temperaturwerte charakterisiert ist. Dies liegt am uneinheitlichen Aufbau des Festkörpers. Beim Wasser gibt es zwar auch plastische Formen, diese sind aber eher exotischer Natur und treten zum Beispiel unter hohem Druck auf.
Weitere Texte zum Thema „Wasser“