 |
| Bild 1 (Foto: Blume) |
 |
| Bild 1 (Foto: Blume) |
„Schneeflöckchen, Weißröckchen, woher kommst Du geschneit?...“
Experimente:
Versuch: Kristallwachstum aus unterkühltem Mineralwasser
Versuch: Resublimation von Wasserdampf
Nicht nur für Skifahrer sind Schneehänge ein Vergnügen. Die weiße Pracht lädt ein
zum Schlittschuhlaufen, Rodeln, Eishockey oder Eisstockschießen. Haben Sie sich
überhaupt schon einmal darüber Gedanken gemacht, warum dies alles möglich ist?
Skifahren und Schlittschuhlaufen können Sie nur, weil die Eiskristalle ein 10 %
größeres Volumen als die Flüssigkeit haben. Durch den Druck, den Sie mit Ihrem Ski
oder Schlittschuh auf das Eis ausüben, verflüssigt es sich, und ein dünner Wasserfilm,
der das Gleiten auf dem Eis überhaupt erst ermöglicht, entsteht.
Klick mich an!
Bild 2: „Schlittschuhläufer“ auf dem Eis
(Foto: Blume)
Das Eisgitter
Schnee und Eis sind hinsichtlich ihres Gitterbaus identisch. Es sind mindestens neun
verschiedene kristalline Phasen bekannt. Diese spielen allerdings nur bei dicken
Schichten von Schnee und Eis, wie sie in Gletschern vorkommen, eine wichtige Rolle.
Bei Normaldruck ähnelt der Gittertyp von Eis dem der hexagonalen Quarzmodifikation
ß-Tridymit (-> Bild 4). Wasser gehört also zum hexagonalen Kristallsystem. Seine
bevorzugte Kristallform ist die eines hexagonalen, also sechseckigen Prismas. Diese
feinen Stäbchen-Kristalle kennen Sie vielleicht aus den Hochalpen: Sie rieseln aus
wolkenlosem Himmel bei besonders tiefen Temperaturen. Man kann sie manchmal aber auch bei
Raureifablagerungen entdecken (-> Bild 3).
Klick mich an!
Bild 3: Hexagonale Prismen im Raureif (Foto: Blume)
Über merkwürdige pelzartige Eiskristallbildungen auf Holz, die aufmerksame Waldwanderer
im Winter öfter sehen, berichten wir auf einer besonderen Webseite.
Man spricht von Kammeis.
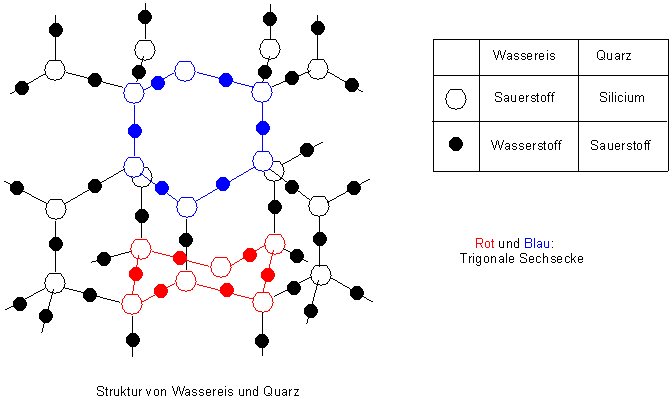
Bild 4
Im Gitter ist jedes Wassermolekül tetraedrisch von vier weiteren umgeben. Jedes
Sauerstoffatom ist an zwei Wasserstoffatome durch kovalente Bindungen und an zwei
weitere durch Wasserstoffbrücken-Bindungen gebunden. Zu Bild 4 ist anzumerken, dass die
H-Atome genau in der Mitte der Verbindungslinie zwischen zwei O-Atomen liegen. Das trägt
der Tatsache Rechnung, dass die Wasserstoffbrücken-Bindungen zwischen den einzelnen
H2O-Molekülen oszillieren.
Die Struktureinheiten sind somit OH4-Tetraeder, deren Wasserstoffatome mit je einem zweiten O-Tetraeder gemeinsam sind. Sechs Wassermoleküle bilden so ein sperriges trigonales Sechseck. So kommt es zur Ausbildung eines riesigen Molekülgitters.
Man kann es auch als Atomgitter, wie es das Quarzgitter repräsentiert, auffassen. Denn die Wasserstoffbrücken-Bindungen beruhen auf recht starken Dipolwechselwirkungen. Dies ist der Grund für die bemerkenswert hohe Schmelztemperatur von Eis (verglichen mit den anderen Hydriden wie H2S, NH3 oder CH4).
In den Hohlräumen kann Eis fremde Stoffe, bevorzugt Gase, einschließen. Damit hat man die Möglichkeit, mit Hilfe von Eis-Bohrkernen die Atmosphärenverhältnisse vergangener Zeiten zu rekonstruieren - wichtig für die gegenwärtig intensiv betriebene Erforschung der Entwicklung des Klimas.
Wassereis sublimiert
Sie haben sich sicherlich schon einmal gefragt, warum an sehr kalten Tagen das Eis von der Straße
verschwindet: Es sublimiert. Deshalb kann man auch an eiskalten Tagen Wäsche trocknen.
Die Sublimation von Wassereis nutzt man bei der Gefriertrocknung (Lyophilisation). Man kühlt das Material
rasch mit flüssigem Stickstoff (-196 °C). Dabei bildet sich eine Eismodifikation, die keine
Volumenveränderung gegenüber dem Wasser zeigt. Dadurch werden Schäden am einzufrierenden Gewebe
vermieden. Dann evakuiert man den Raum. Das Eis sublimiert; den abgezogenen Wasserdampf fängt
man in einer Kühlfalle auf. Mit dieser Methode stellt man z. B. gefriergetrocknete Hefe her,
die nicht mehr aktiviert werden muss.
Wasser resublimiert auch wieder, das heißt, es kristallisiert, ohne vorher flüssig zu
werden. Deshalb überziehen sich sehr kalte Gegenstände rasch mit feinen Eiskristallen, dem
so genannten Reif (-> Versuch). Hierauf beruht auch die Bildung von Raureif.
Bei hoher Luftfeuchtigkeit bilden sich Kristallskelette
Die Eisblumen an den Fensterscheiben sind
Molekülkristalle aus dünnen Lagen von Eiskristallen, die sich durch die Luftfeuchtigkeit
zunächst als Wasser niederschlagen und dann kristallisieren. Man findet sie auch auf Pfützen
nach kalten Nächten. Ausgehend von der charakteristischen hexagonalen Grundform wächst der
Eiskristall dendritisch (griech. dendron, Baum) bevorzugt an den Ecken und Kanten. (Auch Schwefel oder
Metalle bilden solche Dendriten.)
 |
| Bild 5: Eisblumen am Fenster, heute ein eher seltenes Bild...
(Foto: Blume) |
Auch Schneekristalle gehören dazu. Ausgehend von
einem sechseckigen Prisma wachsen bei hohen Wasserdampfkonzentrationen der Luft
bevorzugt die Kanten. Es kommt zum Kristall-Skelettwachstum
und es bilden sich die bekannten Schneesterne.

Bild 6: Schneesterne
(Foto: Blume)
Man kann feststellen, dass es keine zwei identischen Schneekristalle gibt. Ihre
Formenvielfalt hängt im besonderen Maße von der Lufttemperatur, der Luftfeuchtigkeit und der
Wachstumsgeschwindigkeit ab. Sie sind aber immer auf Sechs- oder Dreiecke
zurückzuführen. Im folgenden Bild erkennt man inmitten der Schneesterne solch ein flächiges,
sechseckiges „Starterprisma“.
Klick mich an!
Bild 7: Sechseckiges Prisma inmitten von Schneesternen
(Foto: Blume)
Es gibt übrigens keine achteckigen Schneesterne, auch wenn man sie öfter auf Abbildungen sieht.
Viele Schneesterne verfilzen zu einer Schneeflocke.

Bild 8: Schneeflocke
(Foto: Blume)
Wie entsteht eine Schneeflocke?
In der Atmosphäre bildet sich eine Schneeflocke, wenn die Temperatur unter 0 °C liegt
und die Luft an Wasserdampf übersättigt ist. Noch scheiden sich keine Eiskristalle ab,
da der Kondensationskeim fehlt.
Im Gegensatz zur Bildung von Eiskristallen reichen zur Entstehung kleiner
Wassertröpfchen die in der Luft vorhandenen Staubpartikel aus. Obwohl die
Temperatur unter 0 °C liegt, bilden sich deshalb zunächst Flüssigkeitströpfchen. Nach einiger
Zeit gehen die unterkühlten Wasserpartikel in Eiskristalle über, die durch Anlagerung
weiterer Wassermoleküle aus dem Dampf dendritisch wachsen. Je nach
Temperaturbedingungen und Wachstumsgeschwindigkeit ergibt sich die Form der
Eiskristalle. Ein Kristall stößt mit anderen zusammen, lagert sich an ihnen an, wächst
so mit weiteren zu einer Schneeflocke. Wenn die Schneeflocken groß und schwer
genug sind, fallen sie nach unten.
Eiskristalle im Eiltempo: Die Mineralwasserflasche in der
Tiefkühltruhe
Wie rasch sich Eis aus metastabilem, unterkühltem flüssigen Wasser bildet, können Sie
anhand eines Versuchs zeigen. Öffnen Sie eine Flasche mit unter
0 °C abgekühltem, jedoch noch flüssigem Mineralwasser, so kristallisiert dieses blitzschnell
durch. Hier spielen die CO2-Bläschen die Rolle von Kristallisationskeimen. Hinzu
kommen noch zwei Temperatureffekte, die das metastabile Gleichgewicht destabilisieren helfen:
Erstens kühlt sich Wasser zusätzlich ab, da sich das Gleichgewicht
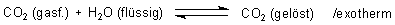
nach links verschiebt. Für weitere Abkühlung sorgt das schlagartige Entspannen des in der Luftblase der Mineralwasserflasche unter dem hohen Druck von ca. 5 bar stehenden Wasserdampfs und CO2-Gases auf Atmosphärendruck. Deshalb beginnt die Kristallisation immer oben an der Flaschenmündung.
 |
| Bild 9: Raureif gibt es auch am Boden (Foto: Blume) |
Raureif
Besonders spektakulär ist der lange Raureif an den Büschen und Bäumen, der sich in
klaren, sehr kalten Nächten bei Temperaturen unter -10 °C bei leichtem Wind anstelle von Tau bildet.
Es handelt sich hier um Resublimation von Wasserdampf, der sich in der Luft befindet (->
Versuch). Die langen Nadeln sind
ebenfalls Dendriten, die durch Skelettwachstum entstehen. Bemerkenswerterweise wachsen sie dem Wind entgegen! Denn
die Luft hat beim Auftreffen auf einen kalten Gegenstand noch ausreichend viel
Wasser geladen, das sie beim Entlangstreichen am Gegenstand oder bereits
gewachsenen Eis ablagert. Dabei nimmt die Luftfeuchtigkeit ab. Dieses Wachsen gegen die
Strömung haben wir auch beim Alaun beobachtet.
Um zu erfahren, warum sich Raureif bevorzugt auf Brücken bildet, klicken Sie Frage 1665 an.
Ist Schnee weiß?
Nein - er ist wasserklar durchsichtig. Da die Eiskristalle aber wie geschliffene Prismen
wirken, werfen sie das Licht zurück. Das lässt den Schnee grellweiß erscheinen. Allerdings sind dicke
Eisschichten wie auch das Wasser selbst blaugrün gefärbt. Lies hierzu auch die Webseite:
Warum ist Wasser blau?
Wie eine Schneekanone funktioniert
Im Winter bleibt immer mehr der Schnee aus. Das ist traurig für die Winterurlaubsorte in
den Alpen. Deshalb machen die sich ihren Schnee selbst.
Durch eine Röhre presst man Druckluft. Das sieht nicht nur wie ein Jettriebwerk aus, sondern
hört sich auch so an. Mittels Düsen sprüht man feinstverteiltes Wasser in den Luftstrahl.
Das sind einige Liter pro Sekunde! Der Wassernebel gefriert sofort und sinkt als Schnee zu
Boden. Das geht aber nur, wenn die Außenlufttemperatur deutlich unter Null Grad Celsius liegt.
Ohne Nachteile ist die Kunstschneeherstellung nicht: Wasserverbrauch und Lärmbelästigung
sind immens. Das Verfahren ist auch sehr energieaufwendig.
Da beißt sich die berühmte Katze in den Schwanz: Zur Bereitstellung der Energie wird
sicherlich auch CO2 freigesetzt, wenn auch wegen der vorrangigen Nutzung von Wasserkraft
in den Alpen weniger als sonst. Außerdem wird durch das Anlegen von Skihängen und durch
den Bergtourismus die Vegetation gestört, die natürliche Senke für CO2 wird geringer.
Damit erwärmt sich die Erdatmosphäre weiter, wenn man den Modellen des Treibhauseffekts
folgt. Das führt zum verstärkten Abschmelzen von Gletschern und Schnee... Und macht
erneut verstärkten Einsatz von Schneekanonen nötig!
Weitere Texte zum Thema „Kristalle“