 |
| Bild 1: Bergkristalle in einer Druse (Lipperland)
(Foto: Daggi) |
Das Quarzgitter
 |
| Bild 1: Bergkristalle in einer Druse (Lipperland)
(Foto: Daggi) |
Der Name Quarz steht symbolhaft für schöne und zugleich besonders stabile Kristalle. Jeder kennt wohl die prächtigen Bergkristalle, von denen es meterhohe und entsprechend dicke Stücke gibt. Dazu kommen noch die verschiedenen Farbvarianten wie Rauchquarz, Amethyst oder Rosenquarz.
Quarz (chemisch: Siliciumdioxid, SiO2) ist sehr hart; seine
Härte nach Mohs beträgt 7. Damit ritzt er sogar Glas an -
wie du leicht ausprobieren kannst.
Die Kristalle sind im Allgemeinen sechseckige Säulen (Prismen) mit einer Art
"Kirchturmspitze", also einer Pyramide oben drauf. In dieser Form wächst er aber nur in
Hohlräumen, in den Drusen. Oftmals gibt es den Quarz aber auch nur als derbes
Ganggestein. Wenn das verwittert, findest du den Quarz als "Kieselsteine".

|
| Bild 2: Kristalle von Tiefquarz
(Foto: Daggi) |
Vom Siliciumdioxid gibt es neben dem Quarz viele Modifikationen. Deren Eigenschaften beruhen auf unterschiedlichen Bildungsbedingungen. Die wichtigsten sind:
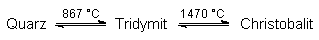
Daneben gibt es noch einige Hochdruckvarianten. Da die Umwandlungsgeschwindigkeiten sehr gering sind, findet man in der Natur alle Formen. Man spricht hier von einem "geologischen Thermometer".
Der Aufbau des Quarzgitters
Beim SiO2-Gitter handelt es sich um ein kovalentes
Atomgitter, an dessen Aufbau zwei Atom-Arten beteiligt sind: Si und O.
Um jedes Si-Atom gruppieren sich in tetraedrischer Anordnung vier O-Atome, danach folgen wieder
Si-Atome und so weiter. Die Modifikationen unterscheiden sich nur in der Anordnung dieser
SiO4-Tetraeder und in den Bindungslängen sowie Bindungswinkeln.
Das System ist spannungsfrei, wenn sich sechs Tetraeder zu einem Sechseck zusammenlagern.
Dabei hat jedes Tetraeder mit dem anderen eine Ecke, also das O-Atom, gemeinsam. Das
Sechseck liegt aus energetischen Gründen in der "Sesselform" vor.
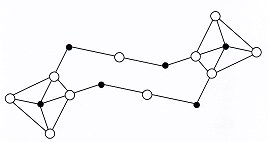
|
| Bild 3: Ausschnitt aus einem SiO2-Kristall.
Es sind aus Übersichtsgründen nur zwei SiO4-Tetraeder gezeichnet. Nicht berücksichtigt sind (ebenfalls aus Übersichtsgründen) die Bindungswinkel zwischen Si-O-Si, die statt 180 ° je nach Modifikation um 160 ° betragen (Zeichnung: Wolfgang) |
Diese Struktur setzt sich durch den ganzen Kristall fort. Daraus resultieren der meistens
sechseckige Grundriss der Quarzkristallsäule und der Pyramidenaufsatz.
(Dies ist übrigens auch die Grundstruktur von Wassereis,
das bekanntlich ebenfalls sechseckige Prismen und dazu noch Sterne bildet.)
Interessant ist der Vergleich zwischen dem "normalen" Quarz (a-Quarz, Tiefquarz), den man als Bergkristall kennt, und dem bei Temperaturen ab 573 °C gebildeten ß-Quarz (Hochquarz). Beide Modifikationen sind ineinander überführbar, ohne dass die Bindungen aufgebrochen werden. Deshalb unterscheiden sie sich nur geringfügig in ihren Bindungswinkeln und Bindungsabständen. Das aber bereits hat schon zur Folge, dass der normale Quarz trigonale, der Hochquarz dagegen hexagonale Kristalle bildet.
Etwas zur Symmetrie der beiden Quarzformen
Du kannst dich überzeugen: Die Säulen eines
Quarzkristalls sind sechseckige Prismen. Daraus kannst du das trigonale und das hexagonale
Kristallsystem durch Vergleiche mit den Sechsringen der organischen Chemie leicht herleiten. Die
Moleküle von Cyclohexan sind sesselförmig, haben drei Symmetrie-Ebenen, sind also
trigonal. Die Moleküle von Benzol sind dagegen planar, haben deshalb
sechs Symmetrie-Ebenen. Sie sind also hexagonal.
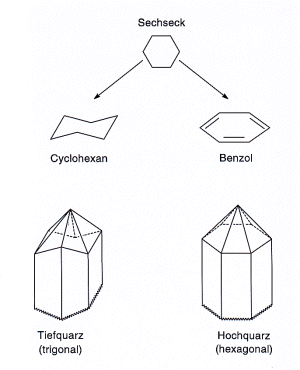 |
| Bild 4: Symmetrie der beiden Quarzmodifikationen
(Zeichnung: Wolfgang) |
Das gleiche gilt für die Pyramiden, die auf den Prismen von Tief- und Hochquarz sitzen.
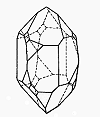
Tiefquarz |
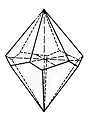
Hochquarz |
| Bild 5: Idealkristalle der beiden Quarzmodifikationen |
Allerdings sind die Verhältnisse in Wahrheit etwas komplizierter, wie die Bilder der echten Kristalle zeigen.

Bild 6: Tiefquarz-Doppelender (Fotos: Blume)
Wenn Quarz belastet wird
Wird ein Quarzkristall stark belastet, zerbricht er. Die Atomgitter-Struktur des
Quarzkristalls ist Grund für den muscheligen Bruch des Kristalls.
In Grenzen sind Quarz-Kristalle jedoch deformierbar. Dabei ist ihre Kompressibilität
erstaunlich hoch.
Übt man senkrecht zu den Ringen Druck auf einen Quarzkristall aus, verschieben sich die
Atome gegeneinander und induzieren dabei eine elektrische Spannung. Dieser Vorgang heißt
Piezoelektrizität; er ist reversibel. Umgekehrt kann man einen
Quarz durch ein elektrisches Wechselfeld zum Schwingen bringen. Darauf beruht die Funktion der
Quarzuhren.
Wenn du zwei Kieselsteine im Dunkeln aneinanderschlägst, erkennst du eine Lichterscheinung. Es handelt sich hierbei aber nicht um einen zündenden Funken, sondern um die so genannte "Deformations-Lumineszenz" (Tribolumineszenz). Machten nicht die Steinzeitmenschen Feuer mit Kieselsteinen? Nein - sie schlugen mit einem Feuerstein, also mikrokristallinem Quarz, an ein Pyritstück. Die dabei entstehenden Funken sind zündwirksam, denn Pyrit FeS2 ist brennbar.
Ist der ausgeübte Druck aber sehr hoch und ist zusätzlich auch noch die Temperatur
erhöht, so bilden sich Hochdruckmodifikationen. Dabei werden die Si-O-Bindungen
aufgebrochen und gruppieren sich so um, dass völlig neue Symmetrien entstehen, die sich
auch im Habitus des Kristalls widerspiegeln.
Es ist deshalb nicht verwunderlich, dass man solche Quarzformen in Einschlagsgebieten
von Meteoriten findet. Damit konnte der langanhaltende Streit, ob es sich beim
Nördlinger Ries um einen Vulkankrater von 20 km Durchmesser oder um die
Einschlagsstelle eines riesigen Meteors handelt, zugunsten letzter Hypothese geklärt werden:
Im Ries findet man tatsächlich eine Hochdruckmodifikation von Quarz. Sie bildet sich bei
Druck oberhalb von 100 000 bar; ihr Name ist Stishovit.
"Zeitzeugen" für diesen Impakt, der vor 20 Millionen Jahren stattfand, findet man heute noch. Durch den Einschlag wurden nämlich riesige Stücke von fossilienhaltigem Jura-Kalkgestein herausgeschleudert und liegen als haushohe erratische Brocken um das Ries herum. Die darin schon vorher enthaltenen Fossilien sind durch die Schockwellen zerstört worden. Das Foto zeigt einen Belemniten, der dabei wie eine Wurst in Scheibchen zerlegt wurde. Durch anschließende Kristallisationsprozesse wurde der Belemnit allerdings wieder "zusammengeklebt".

Bild 7: Durch Schockwellen zerlegter Belemnit aus dem Nördlinger Ries
(Sammlung und Foto: Blume)
Aus Quarzschmelzen bildet sich Glas
Wird Quarz erhitzt, so schmilzt er bei 1705 °C. Kühlt er wieder ab, bildet sich die
Quarz-Struktur nicht zurück. Es entsteht ein Zustand, den wir als unterkühlte
Schmelze bezeichnen. Ein Glas ist entstanden (Quarz-Glas). Auf dieses Thema gehen wir in einer
gesonderten Webseite ein.
Wie aus Quarz Silicate werden
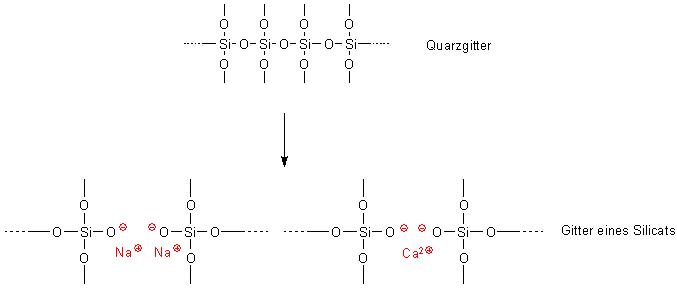
Quarz ist das Anhydrid der Kieselsäure. Deren Salze heißen Silicate. Das kann man auch formal zeigen:
Wenn man in ein Quarzgitter ein Metalloxid wie Na2O oder CaO einfügt, so brechen die Bindungen
auf. Aus Quarz ist so das Silicat geworden.
Wie aus Quarz Alumosilicate werden
Ersetzt man im Quarz-Gitter einzelne Si-Atome durch Atome von Aluminium, so bildet sich
pro Al-Atom eine negative Ladung. Der Grund ist, dass Aluminium ein Valenzelektron weniger
hat als Silicium. Wir erhalten somit ein Anion und sprechen von einem Aluminium-Silicat oder
kurz Alumosilicat.
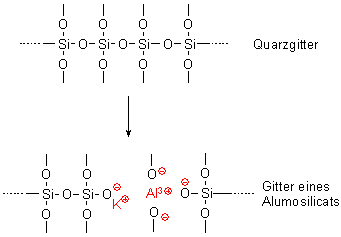
Bild 8: Vergleich von Quarz und Alumosilicat
Die negative Ladung wird durch ein Kation abgesättigt. Wird von vier Si-Atomen eines ersetzt, entsteht z. B. Feldspat, hier der Kalifeldspat K[AlSi3O8].
 |
| Bild 9: Kristall von Kalifeldspat, monoklines Kristallsystem
(Foto: Daggi) |
Statt Aluminium können auch andere Metalle wie Magnesium, Eisen, Beryllium und Titan eingebaut
sein. Auch das Nichtmetall Bor kommt infrage. Dazu kommt noch eine Vielzahl von
Verknüpfungsmöglichkeiten der SiO4-Tetraeder, die als einfache Anionen ("Inseln"), als
Ketten- oder Bänder-, Schicht- und Gerüst-Anionen vorliegen können. Entsprechend gibt es
die Inselsilicate, Ketten- und Bandsilicate, Schicht- und Gerüstsilicate. Zum ersten gehören
der Granat und der Zirkon, zum zweiten Typ die Pyroxene und Amphibole. Schichtsilicate sind
Asbest, Glimmer und Talk. Zu ihnen gehören vor allem auch die Tonmineralien. Gerüstsilicate
sind Feldspäte, Zeolithe und Ultramarine.
Insgesamt bilden die Silicate deshalb eine für Laien schier unüberschaubare Vielzahl
von Mineralien und Gesteinen.
Weitere Texte zum Thema „Kristalle“