 |
| (Foto: Blume) |
 |
| (Foto: Blume) |
Wasser als Korrosionsmedium
Metalle in unserer Umwelt werden leicht angegriffen. Kupfer überzieht sich mit
Grünspan, Silber läuft an und Eisen rostet. Man spricht von Korrosion. Voraussetzung
für all diese Vorgänge, bei denen die Oberfläche von Metallen betroffen ist, ist die
Anwesenheit von Wasser.
Ein Beispiel ist die Sauerstoffkorrosion von Eisen, das Rosten. Dabei läuft folgende
Reaktion ab:
Eisen steht bei Kontakt mit Wasser im Redox-Gleichgewicht mit seinen Ionen.
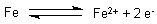
Kommt nun Sauerstoff dazu, übernimmt dieser die Elektronen.
O2 + 2 H2O + 4 e- ———> 4 OH-
Die Hydroxid-Ionen reagieren mit Eisen(II)-Ionen zu schwerlöslichem Eisen(II)-hydroxid.
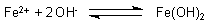
Das beschleunigt den Zersetzungsvorgang des Eisens.
In einer weiteren Reaktion wird das Eisen(II)-hydroxid zu braunem Eisen(III)-hydroxid
oxidiert.
4 Fe(OH)2 + O2 + 2 H2O ———> 4 Fe(OH)3
Rost ist entstanden.
Die Bedeutung des Wassers als zentrales Korrosionsmedium ist von größter wirtschaftlicher Bedeutung, da die Schäden unermeßlich hoch sind.
Aber natürlich hat der Mensch etwas erfunden, was die Korrosion austrickst. Man verbindet
ein unedleres Metall mit dem von Korrosion bedrohten Metall. Dann löst sich diese Platte
eher auf als das Eisen des Schiffrumpfes. So schützt man eiserne Schiffe, indem man große
Platten aus Magnesium, Zink oder Aluminium an ihnen unter der Wasserlinie elektrisch leitend
befestigt. Diese so genannte Opferanode hat die Aufgabe, das zu schützende
Stück negativ aufzuladen. Dann kann es keine positiv geladenen Ionen mehr entwickeln, die
mit Wasserdipolen oder mit Sauerstoff reagieren. Heute hat jede Heizung eine solche Opferanode.
Sie muss aber ab und zu erneuert werden!
Man kann die negative Aufladung aber auch gleich mit Gleichstrom besorgen; das nennt man
kathodischen Korrosionsschutz. Den wendet man vor allem zum Schutz von Brücken wie der
Mittellandkanalbrücke über die Weser in Minden an. Auch Masten von Hochspannungsleitungen werden
so vor Korrosion geschützt.
Genaueres, vor allem auch zur katalytischen Wirkung von Kontaktmetallen, findest du in unserer Webseite.
Wie pH-Wert und Redoxlage das Korrosionsgeschehen beeinflussen beschreiben wir auf einer besonderen Webseite.
Weitere Texte zum Thema „Wasser“