 |
| (Foto: Blume) |
Wasser und Sauerstoff bestimmen das Wohlbefinden (Redoxpotential) unserer Umgebung
 |
| (Foto: Blume) |
Ein sauberer, fließender Bach, der gelösten Sauerstoff enthält, ist für uns mit das
Schönste auf der Welt. Das hat biologische und chemische Gründe: Dieser Bach ist
nicht nur pH-neutral, sondern auch "redoxneutral". Schließlich sind alle höheren
Lebewesen auf neutralen pH-Wert und mittleres Redoxmilieu angewiesen.
In sauberem, gut durchlüfteten Wasser stehen folgende Moleküle bzw. Ionen im Gleichgewicht:
H2...H3O+...H2O...OH- ...O2
Alle sind an den für das Leben wichtigen Redoxreaktionen beteiligt, die für das Potential sorgen, aus dem das Leben die Energie zu seinem Erhalt schöpft.
Es gibt einen quantifizierbaren Zusammenhang zwischen pH-Wert und der
Redoxlage eines Systems.
In natürlichen Systemen liegen die Werte in einem Bereich, der durch das
Redoxsystem des Wasserstoffs einerseits und dem des Sauerstoffsystems
andererseits eingegrenzt werden.
Wasserstoffsystem
| Redoxreaktion | 2 H2 + 4 H2O ———> 4 H3O+ + 4 e- |
| alternativ | 2 H2 + 4 OH- ———> 4 H2O + 4 e- |
| Standardpotential | E0 = -413 mV (bei pH 7) |
| Potentialgleichung | E = 0 - 59 pH - 59/2 log pH2 (mV) |
| vereinfacht | E = - 59 pH (mV) |
Sauerstoffsystem
| Redoxreaktion | O2 + 4 H3O+ + 4 e- ———> 6 H2O |
| alternativ | O2 + 2 H2O + 4 e- ———> 4 OH- |
| Standardpotential | E0 = 816 mV (bei pH 7) |
| Potentialgleichung | E = 1229 - 59 pH + 59/4 log pO2 (mV) |
| vereinfacht | E = 1229 - 59 pH (mV) |
Mit steigendem Wasserstoffdruck nimmt das Potential ab, mit steigendem Sauerstoffdruck nimmt es zu. Zur Vereinfachung setzen wir die Partialdrücke der beiden Gase gleich 1.

Graphik 1: Redoxpotential und pH-Wert des natürlichen Wassersystems
Das Redoxpotential / pH-Diagramm
Die Redoxpotential / pH-Funktionen kennen wir von den bekannten Reaktionen von
Gaselektroden, die zum Beispiel bei der Brennstoffzelle
die zentrale Rolle spielen. Die Linien sind also die Redoxpotential / pH-Kurven der Wasserstoffelektrode
sowie der Sauerstoffelektrode.
Beide Redoxpotentialgleichungen sind in einem Diagramm Spannung = f(pH) zwei
parallele, fallende Geraden mit der Steigung von -59 mV/pH (Bild oben). Die Geraden liegen
um 1229 mV auseinander.
Die Geraden schließen den Stabilitätsbereich von flüssigem Wasser ein.
Oberhalb der Geraden für das Sauerstoff-Redoxgleichgewicht wird Wasser unter
Bildung von Sauerstoff oxidiert.
H2O ———> 2 H+ + ½ O2 + 2 e-
Das kann durch "unnatürliche Stoffe" wie Fluor oder Chlor geschehen. Diese übernehmen die Elektronen aus dem Wasser.
F2 + H2O ———> 2 HF + ½ O2
Unterhalb der Geraden für Wasserstoff wird Wasser unter Bildung von Wasserstoff reduziert.
H2O + e- ———> OH- + ½ H2
Hier wirken "unnatürliche Stoffe" wie die Alkalimetalle oder das Eisen in Lavoisiers Experiment zur Wasserzersetzung. Diese geben Elektronen an das Wasser ab.
Na + H2O ———> NaOH + ½ H2
Dazwischen kann Sauerstoff als Oxidationsmittel wirken. In diesem Bereich laufen alle "gesunden", weil aeroben Lebensprozesse ab, aber auch viele geologische und mineralogische Umwandlungen, Korrosionen und so weiter. Der farbig markierte Teil in der Graphik umfasst den ungefähren Bereich des Redoxsystems unserer Organe bzw. Zellen inklusive dem Blut.
Beispiel Korrosion
Für die Korrosion ist die Stabilität des Eisens und seiner
Sauerstoffverbindungen wichtig. Dabei bilden sich Zustandsflächen aus (->
folgendes Bild). Im oberen Bereich sind Eisen(III)-, im unteren Eisen(II)-Verbindungen stabil.
Im sauren Bereich sind es die freien Ionen, im zunehmend
alkalischen Milieu die Hydroxide sowie die Hydroxy-Komplexe. Außerhalb der
natürlichen und für das Leben notwendigen Redoxzustandsfläche liegt die des
metallischen Eisens, das nur dort stabil ist, wo sich Wasser unter Reduktion zersetzt. Es ist also
nur in reduzierendem Milieu stabil. Das ist der Grund für sein Rosten unter
natürlichen Bedingungen. Reduzierendes Milieu kann man auch künstlich erzeugen
- hier greift der kathodische Korrosionsschutz an.
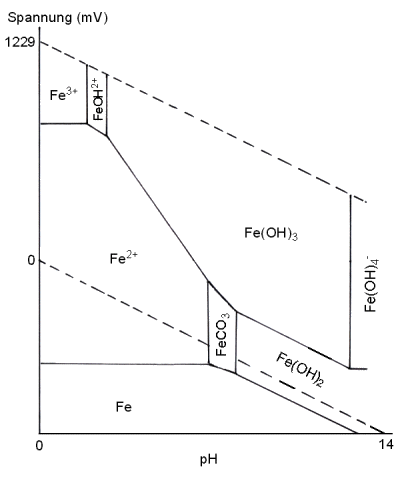
Graphik 2: Zustandsflächen von Eisen und einiger für Korrosionsprozesse wichtigen Eisenverbindungen
Beispiel Biochemie
Statt Sauerstoff können auch andere Substanzen an Reaktionen mit Elektronenübertragung teilnehmen.
Dies sind in der Biochemie Stoffe wie Ascorbinsäure, NAD+ oder die Cytochrome (siehe folgende
Abbildung). Aufgrund ihrer Redoxpotentiale lassen sie sich zu
Reaktionsketten wie die Atmungskette bei der biologischen
Endoxidation anordnen. Das Startpotential der Atmungskette, die von NADH/H+ ausgeht,
ist mit -320 mV höher als das von Wasserstoff (-418 mV bei pH 7), da es sich in einem höheren
Redoxzustand befindet, jedoch noch in einem niedrigeren als Wasser.
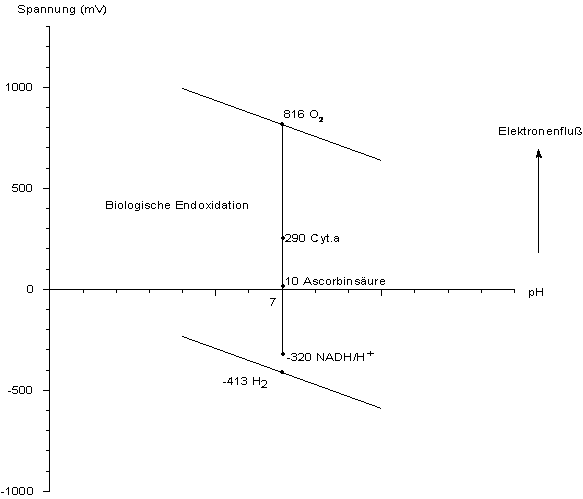
Graphik 3: Biochemische Redoxpotentiale und das Wassersystem
Am Rande der Existenz: Biologische Oxidation und Reduktion von Wasser
Nicht nur durch "unnatürliche Chemikalien" ist die Redoxzersetzung von Wasser möglich. Auch
biologische Systeme gehen an die Grenzen des "grünen Bereichs" in der Graphik 1. Somit nutzt das
Leben das System H2 / H2O / O2 energetisch vollständig aus.
Bemerkenswert ist die Oxidation des Wassers bei der Fotosynthese der Pflanzen und Bakterien. Sie läuft am oberen Ende des grünen Feldes in der Graphik 1 ab.
H2O + Lichtenergie ———> 2 H+ + 2 e- + ½ O2
Oxidationsmittel ist NADP+. Unterstützt wird die Reaktion durch die Enzyme der Lichtreaktion.
H2O + NADP+ + Lichtenergie ———> NADPH + H+ + ½ O2
Auch die biologische Reduktion des Wassers ist möglich. Sie findet am unteren Ende des grünen Feldes in Graphik 1 durch anaerobe Mikroorganismen, die zur Stickstofffixierung befähigt sind, statt. Normalerweise übertragen sie die Elektronen aus dem Abbau von Biomasse (wie z. B. von Glucose) auf elementaren Stickstoff und Protonen.
N2 + 8 H+ + 6 e- ———> 2 NH4+
Reduktionsmittel ist NADPH. Diese endotherme Reaktion ist mit dem Verbrauch von 12 Mol ATP verbunden. Sie wird
durch das Nitrogenasesystem katalysiert.
Bei Stickstoffmangel dient ausschließlich Wasser als Elektronenakzeptor. Genau genommen
sind es die Protonen aus der Eigendissoziation des Wassers, die reduziert werden.
H2O + e- + Energie ———> OH- + ½ H2
Die Elektronen werden auch hier durch Oxidation von NADPH übertragen.
H2O + NADPH ———> OH- + NADP+ + H2
Weitere Texte zum Thema „Wasser“