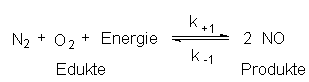
11 Chemische Gleichgewichte
Eine Vorbemerkung:
Der Ausdruck "Gleichgewicht" (z. B. der Natur)
täuscht die absolute Stabilität von dynamischen Systemen vor. So ist das
Ökosystem "Regenwald" im Gleichgewicht (übrigens erst seit ca. 12.000
Jahren). Jeder Organismus hat hierin seine Nische gefunden.
Davon zeugt die ungeheure Artenvielfalt. Aber: das Gleichgewicht
steht sozusagen auf schwachen Füßen, nämlich auf einer nur 25
cm "mächtigen" Bodenkrume. Stört man dieses Gleichgewicht,
indem man Schneisen schlägt oder gar rodet, so verschwindet die
Krume. Das System Regenwald ist damit irreversibel aus dem
Gleichgewicht gebracht.
Die meisten chemischen Reaktionen laufen auf einen Gleichgewichtszustand zu, d.h. die Stoffe werden nicht vollständig umgesetzt. Ab einer gewissen Konzentration bzw. Reaktionszeit ist die Rückbildung genauso groß wie die Zerfallsrate (-> Abb. 21). Hier liegen auch die Schwierigkeiten und Grenzen, einen Schadstoff aus seinem Medium vollständig zu entfernen.
Ein Beispiel für ein chemisches Gleichgewicht ist die Luftverbrennung, d.h. die stark endotherme Bildung von Stickoxiden im Automotor:
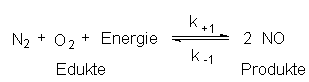
Chemische Gleichgewichte sind abhängig von Druck und Temperatur. So enthält das Gasgemisch bei
Beschrieben wird das Gleichgewicht durch eine druck- und temperaturabhängige Gleichgewichtskonstante K, in die die Geschwindigkeitskonstanten von Bildung und Zerfall sowie die Konzentrationen von Edukten und Produkten eingehen:
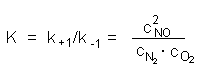
Je größer die Gleichgewichtskonstante ist, desto mehr Produkt bildet sich. Für den o.a. Fall beträgt sie bei
| 11.1 | Verschiebung von chemischen Gleichgewichten. | |
| Prinzip von Le Chatelier |
Chemische Gleichgewichte kann man verschieben. Hierzu wurde schon früh von Le Chatelier ein Prinzip formuliert: Übt man auf ein System einen Zwang aus, so weicht es diesem so aus, da es die Wirkung des Zwanges minimiert. (Dieses Prinzip gilt auch in der menschlichen Gesellschaft oder in der Umweltpolitik.)
Die variablen Parameter zur Gleichgewichtsverschiebung sind Druck, Temperatur und Konzentrationen der Reaktionspartner.
Druck
Dieser wirkt sich nur bei Reaktionen aus, bei denen sich Gase
bilden oder verschwinden. Öffnet man beispielsweise eine Flasche
mit Ammoniaklösung, so kann sich das gelöste Ammoniakgas (wie
das CO2 bei einer Sektflasche) aus der Lösung so rasch entwickeln,
dass Spritzer herausgeschleudert werden und schlimme
Augenverletzungen zur Folge haben können.
Bei der NO-Bildungsreaktion bewirkt Druckerhöhung allerdings keine merkliche Verschiebung des Gleichgewichts zugunsten der Bildung von NO, weil sich die Gasmenge insgesamt nicht verändert.
Temperatur
Das endotherme NO-Gleichgewicht verschiebt sich bei Erhitzen
zur NO-Bildung, bei Abkühlung zum NO-Zerfall.
Ein anderes Beispiel ist das Lösen von schwerlöslichen Salzen, die im Allgemeinen bei Schwermetallen eine wichtige Rolle spielen. Beispielsweise dissoziiert Quecksilbersulfid HgS wie folgt:
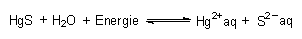
Mit steigender Temperatur wird sich mehr HgS lösen und werden giftige Hg-Ionen freigegeben. Die Gleichgewichtskonstante heißt hier Ionen- oder Löslichkeitsprodukt (-> 14.12.3).
Ein anderes exothermes Lösungsgleichgewicht ist das von Gasen wie NH3, SO2 oder CO2 in Wasser:
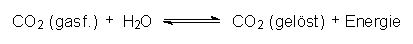
Mit steigender Temperatur löst sich weniger CO2. Oder anders formuliert: Ist die Temperatur des Meerwassers niedrig, so kann es als CO2-Puffer dienen. Kommt es aufgrund des Treibhauseffektes zu einer Aufheizung der Atmosphäre, wird auch das Meer wärmer, es entlässt deshalb bis zur neuen Gleichgewichtseinstellung die nötige Menge CO2 in die Atmosphäre. Diese heizt sich deshalb noch mehr auf und erwärmt auch das Wasser. Noch mehr CO2 entweicht aus dem Wasser (usw.). Der Treibhauseffekt schaukelt sich im Sinne einer positiven Rückkopplung auf.
Konzentrationsveränderung
Entfernt man aus dem Gleichgewicht ein Produkt, indem man es
z. B. abdestilliert oder chemisch abfängt, so verschiebt sich das
Gleichgewicht unter ständiger Produktbildung. (So arbeiten auch
biochemische Prozesse, deren Gleichgewichtslage häufig sehr
ungünstig ist.)
| 1. |
Bei der Estersynthese destilliert man den niedrig siedenden Ester ab:
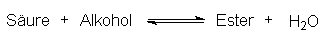 |
| 2. |
Zur Entfernung von SO2 aus Rauchgasen reicht das Einleiten in
Wasser nicht aus, da das Gas beim Einleiten in Wasser einem
Löslichkeitsgleichgewicht unterliegt:
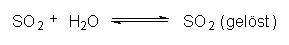 Man kann den Schadstoff jedoch aus den Rauchgasen entfernen, indem man diese statt in Wasser in basische Lösungen wie Kalkwasser einleitet: 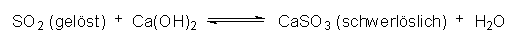 |
| . |
Bei der Abtrennung von Schwermetall-Ionen durch Fällung als
schwer lösliche Salze muss man Gleichgewichte bedenken. Die
Gleichgewichtskonstante ist das "Löslichkeitsprodukt".
L = [Pb2+] · [SO42¯] L = 10¯4 · 10¯4 mol2/l2 |
Da sein Wert konstant ist, kann man durch Erhöhung der Konzentration der einen Komponente die der anderen verringern. Erhöht man z. B. [SO42¯] auf 100 mol l¯1, erniedrigt sich [Pb2+] auf 10¯8 mol l¯1.
Die Menge an gelöstem Salz wird häufig unterschätzt, vor allem auch dann, wenn das Löslichkeitsprodukt klein ist und wenn mehr als zwei Ionen am Lösungsgleichgewicht beteiligt sind. Ein Beispiel ist das schwerlösliche Bleichlorid PbCl2 mit L = 1,6 · 10¯5 (mol/l)3 (20 °C). Wie viel Gramm Blei ist in einem Liter einer gesättigten Lösung enthalten?
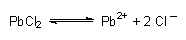
| L | = | cPb · cCl · cCl |
| Mit cCl | = | 2 cPb folgt für die molare Konzentration in mol/l: |
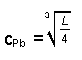 |
= | 1,59 · 10¯2 mol/l |
| Die Konzentration in g/l ist: | ||
| mPb | = | cPb mol/l · MPb g/mol = 3,294 g/l |
Die Trinkwasser-VO schreibt für Blei den Grenzwert 40 µg/l vor. Die gesättigte Lösung von Bleichlorid ist mit ihrem Bleigehalt von 3,294 g/l um den Faktor 8,4 · 104 konzentrierter und entsprechend toxisch.
Man kann diesen Wert titrimetrisch bestimmen, indem man eine gesättigte Bleichloridlösung herstellt, sie vom Bodensatz abfiltriert und eine Probe davon mit verdünnter Salpetersäure ansäuert und mit Silbernitratlösung den Chloridgehalt bestimmt. Dessen halber Wert ist der Gehalt an Blei-Ionen.
Das so genannte Domestos-Problem
Das Gleichgewichtssystem Chlor/Wasser lässt sich durch alle drei
genannten Parameter beliebig verschieben. Leitet man Chlorgas in
Wasser ein, so bildet sich eine saure Lösung von Salzsäure und
unterchloriger Säure:
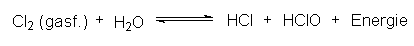
Dieses Gleichgewicht kann man in Richtung auf die Produktbildung verschieben durch:
Letzteres nutzt man zur Herstellung von Haushaltsreinigern wie Domestos, wobei man Chlor in Natronlauge einleitet. Dabei bildet sich eine stark basische und deshalb relativ stabile Mischung von gelöstem Natriumchlorid und Natriumhypochlorit:
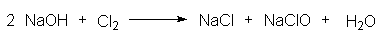
Gibt man nun zu Domestos stark saure Sanitärreiniger, so wird das Gleichgewicht in Richtung auf Chlorbildung rückwärts verschoben. Hinzu kommt die starke Erwärmung durch die Neutralisationsenergie. Es wird insgesamt eine große Menge an Chlorgas freigesetzt.
Leicht verschiebbare Gleichgewichte, an denen schwache Säure/Base-Systeme und reversible Redoxsysteme beteiligt sind, spielen eine wichtige Rolle in Umwelt und Biochemie. Sie sind z. B. Grundlage der Pufferung, worunter man die chemischen Reaktionen zur Stabilisierung des Säure/Base- bzw. Redoxmilieus versteht (-> 14).
11.2 Reaktionshemmung und Aktivierungsenergie
Die Einstellung des chemischen Gleichgewichtszustands ist im Allgemeinen immer gehemmt und erfolgt deshalb nur sehr langsam oder gar nicht. So kann man Benzin- oder Wasserstoff/Luftgemische in geschlossener Flasche ohne Bedenken aufbewahren. Ein anderes Beispiel ist die technische Verwirklichung der exothermen Ammoniaksynthese nach Haber und Bosch, die alle Parameter zur Steuerung von Gleichgewichten in sich vereinigt:
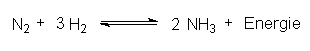
Das Produkt Ammoniak löst sich als Base hervorragend in Säuren und kann leicht aus dem Gleichgewicht entfernt werden. Änderungen von Druck und Temperatur wirken gegenläufig. Optimale Bedingungen wären demnach hoher Druck und niedrige Temperatur. Ersteres stößt auf technische Schwierigkeiten, letzteres auf energetische, da fast alle Reaktionen erst einmal aktiviert werden müssen. Voraussetzung zur Einleitung einer chemischen Reaktion ist, dass sich die beteiligten Moleküle treffen. Bei niedriger Temperatur ist die Stoßenergie der Moleküle zu gering, so dass chemische Umsetzungen ausbleiben. Der technische Kompromiss führt zu folgenden Reaktionsbedingungen:
Beispielsweise müsste das Stickoxid NO sofort zerfallen, wenn es die Bildungshitze des Verbrennungsraums verlässt und in die kalte Außenluft gelangt. Dies geschieht nicht, weil die Zerfallsreaktion bei niedrigen Temperaturen stark gehemmt ist. Vor allem fehlt auch die Metalloberfläche, an der sich NO besonders gut bildet. (Ähnliches gilt für die Dioxinbildung.)
Zur Überwindung dieser Hemmung hat man ein gewisses Startquantum an Energie, die Aktivierungsenergie, vorzugeben. Beispiele für Aktivierung sind:
Ein physikalisches Beispiel für Aktivierung ist die Änderung der Nukleonenzahl um 1 bei der Erbrütung von Plutonium-239 aus stabilem Uran-238 (Kalkar) oder von spaltbarem Uran-233 aus Thorium-232 (Hamm).
Aktivierung ist natürlich auch bei endothermen Reaktionen nötig, auch wenn dies nicht so offensichtlich ist. Ein Beispiel ist die Überspannung bei der Elektrolyse.
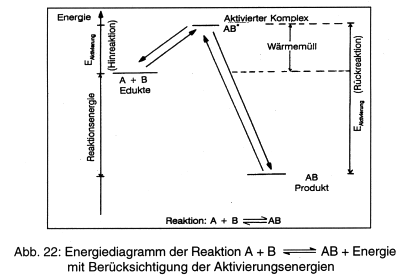
Die Abb. 22 zeigt diese Zusammenhänge für eine Reaktion der Edukte A und B zum Produkt AB:
Zunächst bildet sich unter Aufwand von Aktivierungsenergie ein sog. aktivierter Komplex AB*, ein Reaktionsknäuel, das unter Freisetzung von Energie spontan A und B zurückbilden oder zu AB weiterreagieren kann. (Hier wird der Begriff des dynamischen, chemischen Gleichgewichts deutlich.) Bei der Bildung von AB wird nicht nur die Reaktionsenergie frei, sondern auch die Aktivierungsenergie zurückgewonnen - allerdings als minderwertige Wärme.
Läuft die Reaktion rückwärts, also
so muss zunächst die eben erhaltene gesamte Energiemenge zur Aktivierung von AB zur Bildung des aktivierten Komplexes AB* aufgewandt werden:
Als Wärmemüll fällt hierbei nur die Aktivierungsenergie der Hinreaktion an.
Reaktionshemmungen sind für die Umwelttechnologien von allergrößtem Nachteil. Ihretwegen bleiben Schadstoffe trotz endothermer Bildungsreaktion stabil und werden deshalb in nennenswertem Umfang emittiert. Aber auch bei den exothermen Verfahren zur Abgasreinigung stellt man fest, dass die Stoffe viel zu langsam miteinander reagieren und eine effektive Schadstoffrückhaltung deshalb unterbleibt. Hinzu kommt, dass die Verweildauer des Reaktionsgemisches im Entgiftungsraum (z. B. Auspufftopf) im Allgemeinen nicht beliebig verkürzbar ist, eine vollständige Gleichgewichtseinstellung also nicht abgewartet werden kann.
Man muss deswegen nach Wegen suchen, die Aktivierungsenergie zu senken und die Reaktionsgeschwindigkeit zu erhöhen. Dies geschieht durch die Katalysatoren (-> 12).