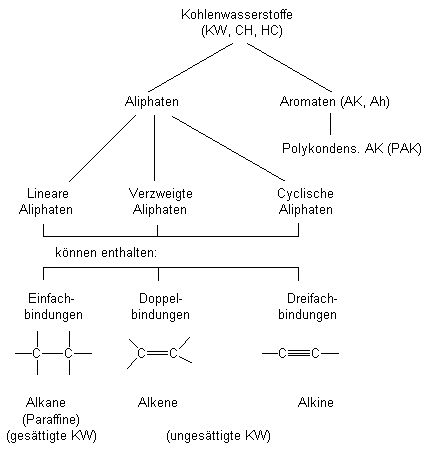
Abb. 36: Überblick über die Kohlenwasserstoffgruppen
16 Organische Chemie
Organische Chemie ist die Chemie des Kohlenstoffs und seiner Verbindungen.
Die Atome des Elements Kohlenstoff haben die Fähigkeit, durch Bindung untereinander mehr oder weniger lange kettenförmige Moleküle (mit oder ohne Verzweigungen) sowie großflächige ringartige Moleküle zu bilden. Damit erklärt sich auch die ungeheure Vielzahl der bislang bekannten organischen Verbindungen: nahezu 20 Millionen hat man bisher charakterisiert und näher untersucht. Bei den meisten weiß man so gut wie nichts über das Verhalten gegenüber der Umwelt oder über deren Toxizität.
Man unterscheidet vor allem die reinen Kohlenwasserstoffe und deren Derivate, die bestimmte funktionelle Gruppen tragen. Diese enthalten zusätzlich andere Elemente wie O, N, S, P oder Halogene.
Im folgenden werden umweltrelevante Beispiele für die wichtigsten Verbindungsklassen der organischen Chemie vorgestellt.
16.1 Kohlenwasserstoffe
Die organisch-chemischen Grundstoffe sind die Kohlenwasserstoffe. Die Abb. 36 gibt einen Überblick. Man unterscheidet nach dem Bindungszustand gesättigte und ungesättigte Kohlenwasserstoffe. Letztere enthalten Mehrfachbindungen, also doppelt oder dreifach gebundenen Kohlenstoff. Dabei unterscheidet man weiter aliphatische und aromatische KW. Erstere sind kettenförmig, letztere cyclisch und stets ungesättigt.

Abb. 36: Überblick über die Kohlenwasserstoffgruppen
16.1.1 Aliphatische Kohlenwasserstoffe
Die Aliphaten sind Alkane (gesättigt), Alkene (ungesättigt mit Doppelbindungen) und Alkine (ungesättigt mit Dreifachbindungen). Die Moleküle können linear, verzweigt oder cyclisch aufgebaut sein.
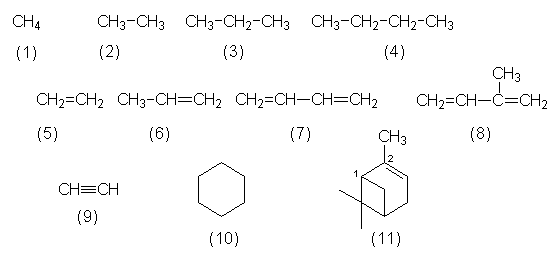
| Alkane | Bemerkungen |
| Methan (1) | Andere Bezeichnungen Erdgas, Sumpfgas.
Leichter als Luft. |
| Ethan (2) | Bestandteil von Erdgas. |
| Propan (3) | Fraktionen des Erdgases. Genutzt als Feuerzeuggas oder alternatives Treibgas. |
| Butan (4) | Butan/Pentan Kühlmittelersatz für FCKW im Kühlschrank. |
| Alkene | |
| Ethen (5) | Alte Bezeichnung Ethylen. Crackgas.
Monomeres von Polyethylen (PE). Reifungsmittel für Bananen. |
| Propylen (6) | Crackgas. Monomeres von Polypropylen (PP).
Wichtig auch für Hocksche Phenol/Aceton- Synthese. |
| Butadien (7) | Synthese von Kunstgummi (Buna). |
| Isopren (8) | Grundsubstanz für natürlichen Kautschuk. |
| Alkine | |
| Ethin (9) | Alte Bezeichnung Acetylen. Aus Calciumcarbid CaC2 gewonnen. Schweiß- und Synthesegas (bildet Vinylverbindungen). |
| Cycloaliphaten | |
| Cyclohexan (10) | Lösemittel. |
| Pinen (11) | Cycloalken. Toxisches Lösemittel, destillativ aus biogenem Terpentinöl gewonnen. |
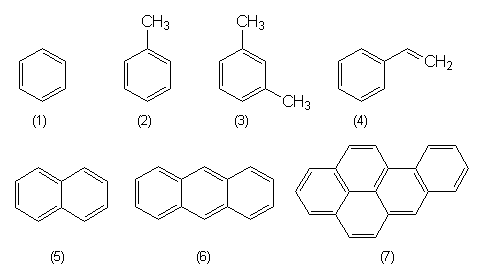
16.1.2 Aromatische Kohlenwasserstoffe
Aromatische Kohlenwasserstoffe bestehen aus einem Ring (Benzol) oder aus mehreren zusammengekoppelten Ringen (polykondensierte aromatische Kohlenwasserstoffe PAK wie Anthracen oder 3,4-Benz[a]pyren). Aromatische Verbindungen befinden sich in dem energetisch besonders günstigen Zustand, der durch die gleichmäßige Verteilung der Doppelbindungselektronen über das gesamte Molekül hinweg erzielt wird. Dieser sogenannte mesomere Zustand ist der Grund dafür, dass sich aromatische Verbindungen besonders leicht bilden und hoch stabil sind, sich chemisch daher kaum angreifen lassen und besonders umweltpersistent sind. Ein Beispiel sind die Dioxine mit einer Halbwertszeit von 160 Jahren. Außerdem sind die mesomeren Elektronen durch elektromagnetische Strahlung besonders leicht anregbar. Aromatische Verbindungen wie Anilin sind deshalb Grundstoffe für die Farbenindustrie (-> 17).
| Aromaten | Bemerkungen |
| Benzol (1) | (Auch "Benzen".) Wichtiges Lösemittel, Zusatz zu Superbenzin. Cancerogen. |
| Toluol (2) | Methylbenzol. Wichtiges Lösemittel. Wie Xylol auch begrenzt Ersatz für Benzol. |
| Xylole (3) | Dimethylbenzole. Lösemittel, Zusatz zu Superbenzin. 1-3 heißen auch BTX-Aromaten. |
| Styrol (4) | Ethenylbenzol. Monomer von Polystyrol (PS). |
| Naphthalin (5) | Geruch nach Mottenkugeln. Grundstoff für Farben, Medikamente und Pestizide (z. B.Carbaryl). |
| Anthracen (6) | Einfacher Vertreter der PAK. Grundstoff für Farben (Anthrachinonfarbstoffe). |
| 3,4-Benzpyren (7) | Benz[a]pyren. Cancerogener Lebensmittelrückstand in Grill- und Räucherwaren. Typisch für Kokerei-Altlasten. |
16.1.3 Isomere
Isomere sind Verbindungen gleicher summarischer Zusammensetzung, aber mit verschiedener Konstitution. Ein Beispiel ist das Paar n-Octan und Isooctan, zwei von insgesamt 18 möglichen Isomeren des Alkans C8H18. (n ist die Abkürzung für Normalform.)
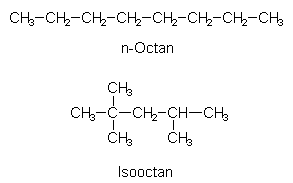
Octane sind typische Bestandteile von Benzin. Isooctan wird als Radikalfänger zugesetzt (-> 5).
16.2 Funktionelle Gruppen
Abkömmlinge (Derivate) der Kohlenwasserstoffe tragen sog. funktionelle Gruppen. Diese bestimmen Eigenschaften und Reaktionen der entsprechenden Verbindungen. Sie sind deshalb von besonderem Interesse.
Die Kohlenwasserstoffreste (abgekürzt R), an denen die funktionellen Gruppen fixiert sind, heißen im Falle des Methans Methyl- (z. B. Methylchlorid CH3Cl, ein CKW), des Ethans Ethyl- (Ethylalkohol C2H5OH), des Propans Propyl- und des Butans Butylrest. Beim Benzol spricht man vom Phenylrest (z. B. Phenylamin C6H5NH2 (Farbengrundstoff Anilin)). Der Rest von Ethen ist der Vinylrest (z. B. Vinylchlorid CH2=CH-Cl).
Auch hier muss man Isomere unterscheiden. Ein einfaches Beispiel ist Propanol C3H8O, das es in der Normalform (Propanol-1, n-Propanol, ein wichtiges Lösemittel) und als Isopropanol (Propanol-2, wichtiges Lösemittel, möglicher Grundstoff für Aceton, Komponente von toxischen Phosphorsäureestern wie Sarin) gibt.
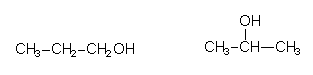
Aber auch die Löse- und Rauschmittel Ethanol und Dimethylether sind Isomere der Verbindung mit der Bruttoformel C2H6O, wenn auch von geringer chemischer Verwandtschaft.
Hier sieht man, dass die reinen Bruttoformeln wenig aussagekräftig sind, dagegen eine halbsterische Formel Aufschluß über funktionelle Gruppen und deren Anordnung zulässt. Ethanol schreibt man deshalb besser C2H5OH oder sogar CH3-CH2OH, den Ether (CH3)2O.
Der Normalfall sind Mischformen, d.h. Moleküle mit mehreren verschiedenen oder gleichen funktionellen Gruppen. Wenn man die meisten komplizierteren Verbindungen betrachtet, findet man an einem Molekül viele funktionelle Gruppen, die insgesamt über Reaktivität, Farbe, Polarität, Löslichkeit und Adsorption entscheiden.
Im folgenden werden die wichtigsten funktionellen Gruppen mit umweltrelevanten Beispielen dargestellt.
Sauerstoffhaltige Derivate
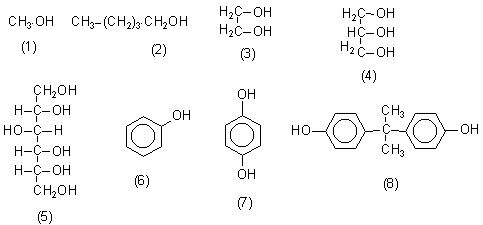
| Alkohole | Bemerkungen |
| R-OH | Die OH-Gruppe heißt Hydroxylgruppe. |
| Methylalkohol (1) | Methanol. Giftiges Lösemittel. Oft in selbstgebranntem Schnaps enthalten. |
| Amylalkohol (2) | n-Pentanol. Giftiges, betäubend riechendes Lösemittel (Geruch von Permanentschreibern und manchen Nagellackentfernern). |
| Glykol (3) | Zweiwertiger Alkohol. Hygroskopisch. Komponente von Polyestern und Polyurethanen. Weichmacher. Frostschutzmittel. Bekannt geworden als süßender Zusatz bei der Fälschung von Weinen. |
| Glycerin (4) | Dreiwertiger, stark hygroskopischer Alkohol. Lebensmittelverträglich. In Feuchtigkeitscremes enthalten. Weichmacher. (Auch "Glycerol" genannt.) |
| Sorbit (5) | Reduzierte Glucose. Zuckeraustauschstoff. |
| Phenol (6) | Benzolalkohol. Ätzend wirkendes Desinfektionsmittel (Lysol). Komponente von Kunststoffen (Harze), Farben, Medikamenten und Pestiziden (z. B. PCP). |
| Hydrochinon (7) | Reduktionsmittel. Daher Entwicklersubstanz in der Fotografie. |
| Bisphenol A (8) | Komponente von Polycarbonaten. |
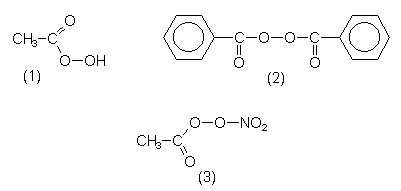
| Peroxide | Bemerkungen |
| R-O-O-R' | |
| Alle Peroxide sind wie konzentrierteres Wasserstoffperoxid labil, teils sogar explosiv. | |
| Peressigsäure (1) | Bildet sich bei der Einwirkung von Bleichmittelaktivatoren auf Perborate. |
| Dibenzoylperoxid (2) | Radikalbildner. Starter von Kunststoffperoxidsynthesen. |
| Peroxyacetylnitrat (3) | PAN. Schadstoff, in Fotooxidantien enthalten. |
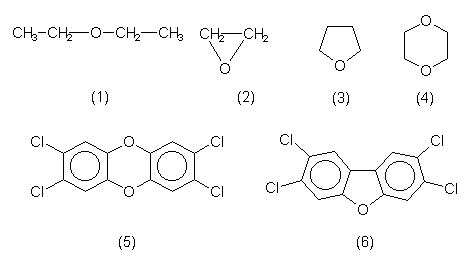
| Ether | Bemerkungen |
| R-O-R' | Die Bindung heißt auch Etherbrücke. |
| Alle Ether bilden beim längeren Stehen - vor allem am Licht - auch in verschlossenen Flaschen hochexplosive Peroxide. | |
| Diethylether (1) | Wichtiges Lösemittel mit betäubender Wirkung. Anästhetikum. Leichtentzündlich. Er enthält CKW zur Stabilisierung. |
| Ethylenoxid (2) | Cyclischer Ether. Einfachstes Epoxid. Komponente bei Synthesen von Polyethern oder Polyestern. |
| Tetrahydrofuran (3) | Lösemittel THF. Herstellbar aus Fructose oder Pentosanen (Abfall bei der Celluloseproduktion). Leichtentzündlich. |
| Dioxan (4) | Cyclischer Doppelether. Allerweltslösemittel, in Spuren in Kosmetika enthalten. Stand im Verdacht, cancerogen zu sein. Name wird oft mit Dioxin verwechselt. Leichtentzündlich. |
| Dioxine (5),
Dibenzofurane (6) |
Substituierte ungesättigte Dioxan- bzw. Furanderivate. |
| Carbonyl-
verbindungen |
Bemerkungen |
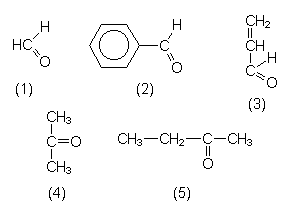
| R-CO-R' | Die CO-Gruppe heißt Carbonylgruppe. |
| Aldehyde | Bemerkungen |
| R-CO-H, andere Schreibweise: R-CHO | |
| Formaldehyd (1) | Hochreaktive Komponente in Kunststoffen, Holzklebern. Allergen. |
| Benzaldehyd (2) | Riecht nach Bittermandeln. Marzipanaromastoff. |
| Acrolein (3) | Ungesättigter, hochreaktiver Vinylaldehyd, entsteht beim Erhitzen von Fett und bei Verbrennungsprozessen (Kfz-Abgase). Typisch stechender, tränenreizender Geruch. |
| Ketone | Bemerkungen |
| R-CO-R' | |
| Aceton (4) | Dimethylketon. Wichtiges Lacklösemittel (Geruch nach Nagellackentferner). Betäubender Geruch. Bewirkt den Komazustand bei Diabetes mellitus. Leichtentzündlich. |
| Ethylmethyl- keton (5) |
Wichtiges Extraktionsmittel, Lacklösemittel. |
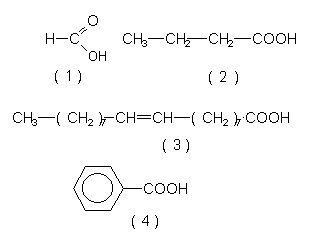
| Carbonsäuren | Bemerkungen |
| R-COOH | Die COOH-Gruppe heißt Carboxylgruppe. |
| Ameisensäure (1) | Stechender Geruch, stark ätzend. Bestandteil von Entkalkern. |
| Buttersäure (2) | Geruch nach ranziger Butter. |
| Ölsäure (3) | Beispiel für eine ungesättigte Fettsäure. |
| Benzoesäure (4) | Grundlage von Medikamenten und von Konservierungsmitteln (Fungizid). |
| Säureanhydride | Bemerkungen |
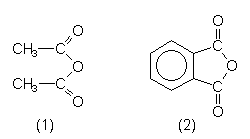
| Essigsäure- anhydrid (1) |
Komponente zur Herstellung von Heroin aus Morphinbase. |
| Phthalsäure- anhydrid (2) |
Polyesterkomponente. Synthese von Weichmachern. |