4.4 Bleichmittel
Bleichmittel zerstören Schmutz durch chemische Umwandlung, vor allem durch Oxidation. Dabei werden farbige Anschmutzungen in nicht farbige Verbindungen überführt, die meist sogar wasserlöslich sind und deshalb leicht entfernt werden können. Das ist zur Entfernung hartnäckiger Farbstoffanschmutzungen (z. B. Kaffee, Tee, Obst, Wein, Blut) notwendig, da sie an Textilfasern zu fest haften.
Bleichmittel zerstören aber auch Textilfarbstoffe, so dass in Feinwaschmitteln keine Bleichmittel enthalten sein sollten.
In den letzten Jahren hat sich die so genannte Sauerstoffbleiche durchgesetzt, die weniger umweltbelastend ist als die "Chlorbleiche". Die Bleichwirkung bei der Sauerstoffbleiche geht von atomarem Sauerstoff [O] ("aktiver Sauerstoff") aus, der wesentlich reaktionsfreudiger ist als molekularer Sauerstoff (O2).
Bleichmittel enthalten "aktiven Sauerstoff" in chemisch gebundener Form. Mit Ausnahme von Natriumhypochlorit sind alle verwendeten Bleichmittel so genannte Peroxo-Verbindungen. Die folgende Tabelle gibt einen Überblick (-> Tab. 12).
| Tabelle 12: Bleichmittel | |
| Substanz | Formel |
| Natriumhypochlorit | (NaOCl) |
| Wasserstoffperoxid | (H2O2) |
| Perborat | (NaBO2 · H2O2) |
| Percarbonat | (2 Na2CO3 · 3 H2O2) |
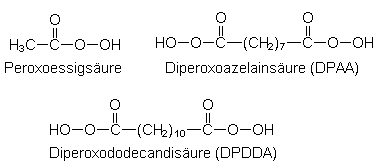
| Peroxoessigsäure | (Strukturformel s. u.) |
| Diperoxoazelainsäure | (Strukturformel s. u.) |
| Diperoxododecandisäure | (Strukturformel s. u.) |

4.4.1 Chemische Grundlagen der Bleichmittelwirkung
Natriumhypochlorit:
Die Bleichwirkung von Natriumhypochlorit ("Chlorbleiche") beruht
auf der Freisetzung von "aktivem Sauerstoff" [O]:
Die Bleichwirkung setzt in wässriger Lösung bereits bei Raumtemperatur ein. Dies ist ein wesentlicher Vorteil dieser "Chlorbleiche". Natriumhypochlorit wird als Bestandteil von Bleich- und Reinigungsmitteln trotz des günstigen Preises, der hohen Wirksamkeit und der erwünschten antimikrobiellen Wirkung bei gleichzeitiger Freisetzung von nur wenig umweltbelastenden Zerfallsprodukten (Chlorid-Ionen, Wasser und Sauerstoff) immer weniger verwendet. Hierfür sind mehrere Aspekte verantwortlich. Das Bleichmittel führt zur Gewässeraufsalzung und kann durch Nebenreaktionen toxische Chlorverbindungen erzeugen. Es greift Fasern stärker an als andere Bleichmittel. Bei langer Lagerung zerfällt Natriumhypochlorit in Kochsalz und Natriumchlorat:
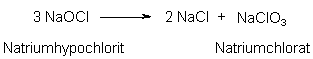
Natriumchlorat ist der Wirkungsbestandteil des "Unkraut"-Vernichtungsmittels "Unkrautex". Außerdem ist es ein starkes Oxidationsmittel, dass bei Kontakt mit organischen Materialien zu Explosionen führen kann.
Beim Mischen von Hypochlorit mit Säuren (in WC-Reinigern enthalten) wird hochgiftiges Chlorgas freigesetzt. Im Haushalt stellt dies ein erhebliches Unfallrisiko dar [15]:
Wasserstoffperoxid:
Wasserstoffperoxid wirkt beispielsweise in der Waschlauge durch
den basisch katalysierten Zerfall direkt als Bleichmittel:
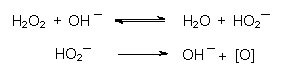
Perborat und Percarbonat:
Die Bleichwirkung von Perborat und Percarbonat beruht auf der
Bildung von Wasserstoffperoxid. Dies geschieht aber erst bei
Temperaturen ab 60 C. Das abgespaltene H2O2 reagiert dann wie
oben beschrieben unter Freisetzung von "aktivem Sauerstoff" [O].
Der Reaktionsverlauf soll am Beispiel von Natriumperborat
verdeutlicht werden:
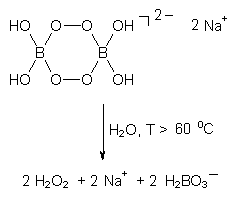
Das entstandene Wasserstoffperoxid zerfällt in der alkalischen Waschlauge unter Bildung von "aktivem Sauerstoff" (-> s. o.: Wasserstoffperoxid).
4.4.2 Bleichmittelaktivatoren
Um mit dem in Waschmitteln viel verwendeten Perborat ebenfalls bei niedrigen Temperaturen bleichen zu können, müssen Aktivatoren (Tetraacetylethylendiamin; TAED oder Tetraacetylglykoluril; TAGU) zugesetzt werden. Diese bilden im alkalischen Medium durch Reaktion mit dem Perborat auch bei unter 60 °C eine bleichaktive Verbindung, die Peroxoessigsäure [5].
Die Bildung von Peroxoessigsäure aus Natriumperborat wird für TAGU und TAED in den folgenden beiden Gleichungen beschrieben:
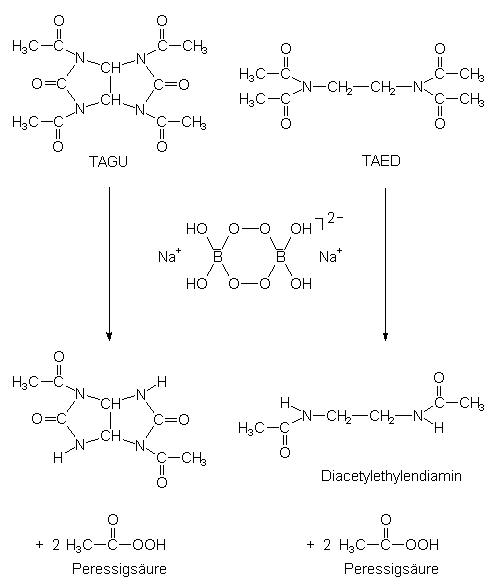
Die so gebildete Peroxoessigsäure zerfällt bereits bei Raumtemperatur unter Abgabe von "aktivem Sauerstoff" (-> s. u.: Peroxosäuren).
Peroxosäuren:
Peroxosäuren geben bereits ab 30 °C "aktiven Sauerstoff" ab, wie
das Beispiel der Peroxoessigsäure (Peressigsäure) zeigt. Das gilt
auch für andere Peroxocarbonsäuren:
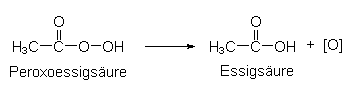
Diese bereits bei Raumtemperatur einsetzende Bleiche hat einen erheblichen Vorteil gegenüber der herkömmlichen Perborat-Bleiche, da auf Bleichmittelaktivatoren verzichtet werden kann.
4.4.3 Wirksamkeit von Bleichmitteln
Ein wesentliches Kriterium bei der Beurteilung von Bleichmitteln ist deren Wirksamkeit. In Tabelle 13 wird der Weißgrad (Remission) von Wäsche nach verschiedenen Bleichverfahren verglichen:
| Tab. 13: Remission (Weißgrad) nach verschiedenen Bleichen [7]: | ||
| Bleichmittel | Temperatur | Remission (%) |
| a) Perborat | 45 °C | » 59 |
| b) Perborat mit Aktivator | 45 °C | » 66 |
| c) Peroxoessigsäure | 40 °C | » 66 |
| d) Diperoxododecandisäure | 40 °C | » 67 |
| Bleichmittelkonzentrationen: | ||
| a und b: | c(Perborat) = 1,5 g/l | |
| c: | c(Peroxoessigsäure) = 0,14 g/l | |
| d: | c(Diperoxododecandisäure) = 0,24 g/l | |
Aus der Tabelle ist ersichtlich, dass Perborat ohne Aktivator eine deutlich unterdurchschnittliche Bleichwirkung hat. Die Peroxosäuren haben etwa die gleiche Bleichwirkung wie das Perborat mit Aktivator, können aber in geringerer Menge dosiert werden. Für eine Remission von etwa 60 - 65 % des eingestrahlten Lichtes sind etwa 1,5 g Perborat pro Liter Waschlauge und zusätzlich ein Aktivator notwendig. Man benötigt aber nur etwa 1/10 dieser Menge an Peroxoessigsäure oder 1/6 der Menge an Diperoxododecandisäure.
4.4.4 Bleichmittel im Vergleich
Die oben genannten Bleichmittel zeichnen sich durch verschiedene Vor- und Nachteile aus, die zusammenfassend diskutiert werden sollen:
Die Perboratbleiche ist erst ab etwa 60 °C Waschlaugentemperatur wirksam. Um auch bei niedrigeren Temperaturen eine befriedigende Bleichwirkung zu erzielen sind Bleichmittelaktivatoren notwendig, die in Kläranlagen nicht ausreichend zurückgehalten werden.
Die umweltfreundlicheren Bleichmittel haben meist anwendungstechnische Nachteile. So ist H2O2 eine stark ätzende Flüssigkeit, die im Haushalt wegen ihrer Gefährlichkeit problematisch ist. Peroxoessigsäure ist nur geringfügig ungefährlicher. Etwas sicherer ist die Diperoxododecandisäure zu handhaben. Beim Percarbonat ist die Handhabung sehr sicher, allerdings ist Percarbonat nicht so lagerstabil und erst ab 60-70 °C wirksam. Deshalb ist auch Percarbonat nicht ohne Aktivator bei niedrigen Temperaturen einsetzbar.
Die Peroxosäuren sind noch nicht ausreichend verfügbar und als Waschmittelzusätze auch noch nicht vollständig untersucht, so dass ihre Anwendung erst in einigen Jahren zu erwarten ist. Es sind aber mit Sicherheit nach Gebrauch keine toxischen Abbauprodukte zu erwarten. Aus den Peroxosäuren werden Carbonsäuren, die biologisch vollständig abbaubar sind.
4.4.5 Umweltverhalten von Bleichmitteln
Bezüglich der Umweltrelevanz der einzelnen Bleichmittel sind folgende Aussagen zu machen:
Die Umweltschädlichkeit von Perborat ist bedenklich, weil Borverbindungen in Kläranlagen nicht zurückgehalten werden. Bor beeinträchtigt ab etwa 0,35 mg/l (0,3 ppm) das Wachstum von Wasserpflanzen (Röhricht) [12]. Tomaten und Apfelbäume reagieren mit Schäden, wenn das Gießwasser mehr als 0,3 mg/l enthält, ein Wert, der gelegentlich in der Ruhr erreicht wird [12].
Alle anderen genannten Bleichmittel sind weniger umweltgefährdend. Percarbonat erhöht geringfügig die Gewässeraufsalzung, ist aber sonst umweltverträglich. Die Peroxosäuren sind vollständig biologisch abbaubar, erhöhen also nur den BSB (biologischer Sauerstoffbedarf beim Abbau organischer Verbindungen im Wasser) in Kläranlagen.