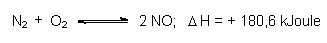
5.3 Stickstoffchemie
Zunächst war Stickstoffchemie gleichbedeutend mit Salpeter- und Schwarzpulverchemie. Dann erkannte man, dass Stickstoff charakteristischer Bestandteil von Biomasse ist. Daraus folgte die Einführung von gezielt zusammengesetzten Düngern aus mineralischen Vorkommen wie dem Chilesalpeter oder aus den ammoniakhaltigen Gaswäschen von Kokereien bzw. Gaswerken (-> 5.9.2).
Die Zunahme der Bevölkerung steigerte die Nachfrage nach Stickstoffverbindungen. Der Bedarf konnte aus den bisherigen Quellen nicht mehr gedeckt werden. Andererseits bestehen 78 % unserer Atmosphäre aus diesem Element. Deshalb wurde schon im letzten Jahrhundert versucht, Stickstoffverbindungen mit Wasserstoff und Sauerstoff direkt aus den Elementen zu synthetisieren.
Das Problem ist: Stickstoff ist chemisch äußerst inert. Zur Herstellung von Verbindungen mit anderen Elementen sind hohe Reaktions- oder Aktivierungsenergien notwendig.
5.3.1 Luftverbrennung
Bei der so genannten Luftverbrennung erhitzt man Luft im Lichtbogen. Hier ahmt man die Natur nach: Bei Gewittern laufen ähnliche Vorgänge ab. Die Lage dieses endothermen Bildungsgleichgewichts ist sehr ungünstig. Bei 2000 °c enthält das Gleichgewichtsgemisch maximal 1 % NO. Danach sinkt der Anteil wieder.
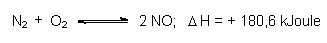
5.3.2 Ammoniaksynthese
Eleganter ist es, das Dreifachbindungssystem des Stickstoffs durch Wechselwirkung mit einem anderen Stoff zu lockern und damit einen Umsatz einzuleiten. Dies geschieht an den Oberflächen von heterogenen Katalysatoren wie Eisen. Damit wird die Aktivierungsenergie herabgesetzt und der Stickstoff in die Lage versetzt, auch unter annehmbaren Bedingungen mit anderen Elementen zu reagieren.
Ein Beispiel hierfür ist die Ammoniaksynthese von Haber und Bosch. Der Chemiker Haber erhielt für dieses Verfahren 1918 den Nobelpreis.
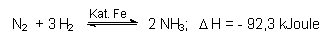
Chemische Gleichgewichte lassen sich verschieben. Als Veränderliche kommen Druck, Temperatur und stoffliche Zusammensetzung in Frage.
Da Gase beteiligt sind, ist das Gleichgewicht zunächst druckabhängig. Je größer der Druck ist, desto mehr sollte sich das Gleichgewicht in Richtung auf die Bildung von NH3 verschieben. Dies hat technische Grenzen: Die Reaktoren sind aus Stahl, einer Eisenlegierung mit Kohlenstoff. Stahl wird unter Einwirkung von Wasserstoff entkohlt, es bildet sich Methan. Weicheisen bleibt zurück. Irgendwann muss der Reaktor platzen. Deshalb konstruierte Bosch Durchfluss-Reaktoren aus kohlenstofffreiem Weicheisen, die mit Strahltrossen umwickelt werden und 200 atm Druck aushalten (sog. Wickelöfen).
Zur Temperatur als nächstem Parameter: Die Bildung von Ammoniak ist exotherm, also sollte Abkühlung die Reaktion fördern. Die Reaktion muss aber aktiviert werden. Die Aktivierungsenergie liegt bei 220 kJoule/mol NH3, ist also viel größer als die freiwerdende Energie der gesamten Reaktion. Damit wäre die Rückreaktion begünstigt. Aktivierungsenergien senkt man mit Katalysatoren, hier mit Eisen. Die Katalysatormasse stammt übrigens aus den eisenoxidhaltigen Rückständen bei der Aufarbeitung von Bauxit zur Gewinnung von Aluminiumoxid (Rotschlamm; -> Abb. 14). Das katalytisch wirkende Eisen bildet sich durch Reduktion mit dem Wasserstoff.
Bei 500 °C und 1 atm enthält die Gleichgewichtsmischung nur 0,13 Vol% NH3. Bei 500 °C und 200 atm steigt der Anteil schon auf 17,6 Vol% NH3. Dies ist auch gleichzeitig der technische Kompromiss. Der Wert reduziert sich allerdings noch auf 11 Vol%, weil die kurze Verweildauer der Gasmischung an der Oberfläche des Katalysators nicht zur vollständigen Gleichgewichteinstellung ausreicht.
Weiter verschiebt man das Gleichgewicht, indem man ständig das Produkt aus dem Gleichgewicht entfernt. Dazu leitet man die Mischung durch kaltes Wasser, in dem sich Ammoniak hervorragend löst (700 l NH3 in 1 l Wasser bei 25 °C). Bei der Düngemittelherstellung führt man die Gase direkt in Schwefel- oder Phosphorsäure. Die freiwerdende Neutralisationswärme (Prozesswärme) setzt man im Sinne eines Energierecyclings wieder zur Erhitzung der Gase vor der Reaktion ein.
Woher bekommt man die Gase? Stickstoff erhält man durch Luftverflüssigung nach dem Lindeverfahren. Den Wasserstoff stellte man früher aus erhitzter Kohle und Wasserdampf her (-> 5.9). Heute crackt man katalytisch petrochemische Produkte wie Erdgas oder andere Kohlenwasserstoffe. Damit ist die Ernährung der Dritten Welt extrem abhängig vom Erdölmarkt geworden.
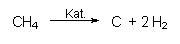
5.3.3 Biologische Stickstofffixierung
Symbiotische Wurzelknöllchenbewohner oder Bodenbakterien besitzen ein ausgefeiltes Reaktionssystem zur Stickstofffixierung, mit dem sie Ammoniak vergleichsweise günstig, umweltschonend und isotherm, d. h. ohne Abwärme synthetisieren. Dafür sorgt ein Enzymsystem, der Nitrogenasekomplex, der die Aktivierungsenergie bedeutend herabsetzt, indem er die Reaktion in viele kleine Schritte zerlegt und dabei für die optimale Ausrichtung der beteiligten Moleküle sorgt. Die Nitrogenase enthält im aktiven Zentrum übrigens Komplexe mit Molybdän Mo oder Vanadium V sowie Eisen. Haber und Bosch waren also, ohne es zu wissen, auf die gleiche Spur geraten wie die Evolution.
Die Bakterien reduzieren den Luftstickstoff bis zur Wertigkeitsstufe von Ammoniak. Als Reduktionsmittel dienen Stoffe wie NADH und NADPH, also letztlich Wasserstoff aus Verbindungen wie den Kohlenhydraten, die die Bakterien von den mit ihnen in symbiotischer Gemeinschaft lebenden Pflanzen erhalten. Die Reduktionsenergie wird in der Form von ATP, der bekannten Energiewährung der Zelle, eingesetzt.
5.3.4 Ammoniakverbrennung und Salpetersäure
Ammoniak - also gebundenen Stickstoff - kann man wesentlich leichter als elementaren Stickstoff verbrennen.
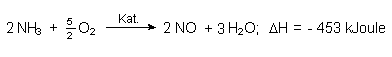
Es entstehen Stickoxide, die mit Wasser umgesetzt letztlich zu Salpetersäure reagieren.
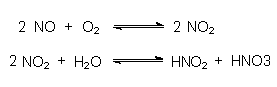
Die Salpetersäure ist äußerst aggressiv. Mit ihr lassen sich beispielsweise Sprengstoffe herstellen, wie die folgende Abbildung zeigt:
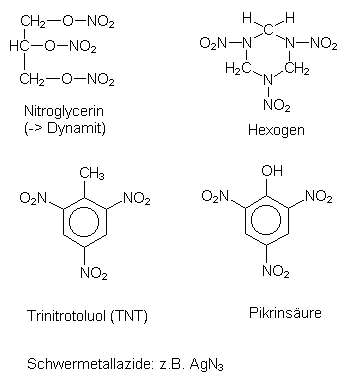
Abb. 10: Sprengstoffe
So ist die Kehrseite der Düngerchemie die Sprengstoffchemie. Haber und Bosch wurden deshalb so großzügig unterstützt, weil das deutsche Kriegsministerium, angesichts der zunehmenden Isolierung Deutschlands, sich mehr und mehr von den natürlichen Salpetervorkommen der Welt abgeschnitten sah und von der Bedeutung der Ammoniaksynthese für die Salpetersäuregewinnung überzeugt werden konnte.
Nach der großtechnischen Stickstoffixierung erfuhr die Stickstoffchemie einen großen Aufschwung, besonders in der geschätzten Farben-, Medikamenten- und Kunststoffindustrie (um nur einige Beispiele zu nennen).
Es gibt aber auch andere Beispiele:
Moderne Raketen werden mit Mischungen aus Hydrazin N2H4 und
Salpetersäure oder Distickstofftetroxid N2O4.
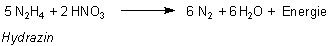
Azide von Schwermetallen dienen als Initialzünder (z. B. AgN3, Hg(N3)2). Eine Verbindung zwischen Bor und Stickstoff (Borazid BN) ist hart wie Diamant, dabei aber wesentlich billiger.
Sieht man einmal von der Verwendung in Sprengstoffen ab, so waren Stickstoff und seine Verbindungen weitgehend positiv beurteilte Stoffe. (Sprengstoffe brauchte man schließlich auch beim Straßen- oder Staudammbau oder bei der Gewinnung von Baumaterial im Steinbruch.)
In der Gegenwart ist Stickstoff ins Gerede geraten. Negativ besetzte Schlagworte, die irgendwie Stickstoffverbindungen betreffen, sind auf der folgenden Abbildung zusammengestellt. Diese Begriffe werden uns immer wieder begegnen.
|
Abgase von Kraftfahrzeugen und Wärmekraftwerken,
Stickoxide (NOx) Quellgase, Photosmog, Radikale, stratosphärische Ozonzerstörung und bodennahe Ozonbildung, Peroxoacetylnitrat (PAN), Waldsterben, Saurer Regen, Entstickung, Katalysator, Nitrat, Nitritpökelsalz, Grundwasservergiftung, Blausucht von Kleinkindern, Nitrosamine, Krebs, Mutationen. |
In diesem Zusammenhang stehen ganz besonders zwei Gruppen von Stickstoffverbindungen im Mittelpunkt umweltchemischer Erörterungen: Die Düngemittel und die Stickoxide.