5.4.1 Gewinnung und Verwendung von Kupfer
Eine Voraussetzung zur wirtschaftlichen Gewinnung von Metallen sind abbauwürdige Erzvorkommen, in denen die gesuchten Metalle oder ihre Verbindungen in einer solchen Konzentration vorhanden sind, dass sich die Ausbeutung der Lagerstätten lohnt. Mit abnehmender Konzentration des Metalls in einem Gestein wird der Aufwand zur Gewinnung umso größer. Damit steigt aber auch die Umweltbelastung. Es ist somit anzustreben, Verfahren zu entwickeln, um auch Erze mit niedrigem Metallgehalt so aufzuarbeiten, dass dies nicht nur möglichst billig, sondern auch besonders umweltschonend geschieht. Dies betrifft auch alte Abraumhalden.
Ein Beispiel ist die Gewinnung von Kupfer. Dieses Metall ist besonders wegen seiner hohen elektrischen Leitfähigkeit, seiner Beständigkeit und als wichtiges Legierungsmetall von großer wirtschaftlicher Bedeutung. Voraussetzung hierfür ist aber hochreines Metall.
Die weltweit bekannten Kupfervorkommen enthalten im Durchschnitt nur etwa 1-2 % Kupfer. Aufgrund des Schwefelanteils vieler Erze (das wichtigste Kupfererz ist der Kupferkies CuFeS2) sowie wegen des Gehalts an anderen, sehr giftigen Schwermetallen und an Arsen besteht das Problem, Kupfer unter möglichst geringen Umweltbelastungen, dabei aber wirtschaftlich lohnend zu gewinnen.
Aktuelles Stichwort Kieselrot
Der wegen seiner hohen Dioxinbelastung 1991 ins Gerede geratene
rote Belag von Sportplätzen ("Kieselrot") ist die Schlacke aus einem
veralteten Verfahren zur Gewinnung von Kupfer, dem "chlorierenden
Rösten".
Bei diesem Trocken-Nassverfahren verarbeitete man kupferhaltige Kiesabbrände, die bei der Schwefelsäureproduktion aus Pyrit anfallen (vor längerer Zeit noch in Duisburg) oder kupferarme Erze (wie im sauerländischen Marsberg).
Das Material, das Kupfersulfid und -oxid enthält, wird gemahlen, mit 10-12 % Kochsalz versetzt und in Schachtöfen mit offener Flamme (Kohle oder Erdgas) unter Sauerstoffüberschuss erhitzt. Dabei läuft vor allem die folgende Reaktion ab:
Analog reagiert Pyrit zu Eisensulfat.
Kupfersulfat zersetzt sich beim stärkeren Erhitzen leicht zu schwarzem Kupferoxid, das nicht herauslösbar ist. Dagegen ist das Chlorid von Kupfer stabil und leicht löslich. Dies ist der Grund, weshalb man vor dem Rösten Natriumchlorid zuschlägt:
Das Koppelprodukt Natriumsulfat ist ebenfalls hitzestabil.
Hierbei bildet sich auch Eisenchlorid. Dieses setzt noch das restliche Kupferoxid um:
Eisenoxid gibt der Schlacke den typischen roten Farbton.
Durch Auswaschen der Röstgase erhält man eine verdünnte Mischsäure (HCl/H2SO4), mit der die Kupfersalze zusammen mit dem Natriumsulfat herausgelöst werden. Anschließend reduziert man sie mit Eisenschrott zu metallischem Kupfer (Zementieren). Natriumsulfat (Glaubersalz, eine wichtige Grundchemikalie) wird ebenfalls abgetrennt.
Das chlorierende Rösten wurde nach dem Kriege bald aufgegeben, da es sehr viel Abgase und Rückstände produzierte sowie zu energieaufwendig und somit völlig unwirtschaftlich war.
Vor allem sind optimale Bedingungen zur Bildung von Dioxinen und Dibenzofuranen gegeben. Als thermodynamisch äußerst begünstigte Verbindungen entstehen sie in exothermer Reaktion aus organischen Verbindungen (der devonische Marsberger Kupferschiefer enthielt bis zu 10 % Bitumen!), Sauerstoff und Chlorverbindungen. Dies läuft vor allem in der Abkühlphase im Schachtofen ab. Hinzu kommt, dass dieser Prozess (wie auch in MVA) durch Schwermetalle katalysiert wird. Besonders wirksam sind ausgerechnet Kupfer und Eisen. Dadurch wurden offenbar Konzentrationen von 0,1 mg Dioxin/kg Schlacke erreicht.
Da dieses Verfahren bereits seit 1850 angewendet wird, wird man sich wegen der hohen Bodenpersistenz von Dioxin (Halbwertszeit 160 Jahre) weiterhin auf Überraschungen einstellen müssen. Das Kieselrot gast die schwerflüchtigen Verbindungen anhaltend aus. Offenbar ist hier die Quelle für die ständige, bislang unerklärliche Grundbelastung der Atmosphäre an Dioxinen gefunden worden.
Das klassische pyrometallurgische Verfahren
Zunächst wird der Kupferkies mit kieselsäurehaltigen Zuschlägen
geröstet, d. h. unter oxidierenden Bedingungen erhitzt. Dabei wird ein
großer Teil des Eisens verschlackt. Ein Teil bleibt als Mischung von
Eisensulfid und Kupfer(I)-sulfid zurück, die durch erneute oxidative
Verschlackung bei 900 °C getrennt werden. Nun werden ca. 2/3 des
Kupfer(I)-sulfids oxidiert. Diese reagieren mit dem restlichen Sulfid zu
Rohkupfer und SO2:
Zur Abtrennung von Verunreinigungen wie Blei, Zink, Antimon, Arsen, Nickel und Eisenresten wird das Rohkupfer einer erst oxidierenden, dann reduzierenden Raffinationsschmelze unterworfen. Hierbei verflüchtigen sich Schwermetalle wie Zink, Blei und Antimon sowie Arsen und müssen aus der Abluft abgeschieden werden. Nickel und Eisen verschlacken mit den beigegebenen Zusätzen.
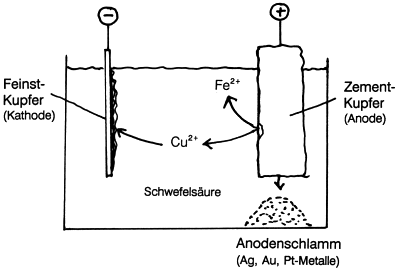
Bei der anschließenden elektrolytischen Raffination (-> Abb. 12) schaltet man die gegossenen Rohkupferplatten als Anode gegen Reinstkupferstäbe als Kathode. Man erhält dabei das für technische Zwecke erforderliche, äußerst reine Kupfer. Vorhandene unedlere Metalle bleiben in Lösung, während sich edlere Metalle wie Gold Au und die Platinmetalle im Anodenschlamm sammeln. (Deren weitere Aufarbeitung erhöht die Gewinne bei der Cu-Herstellung.)

Abb. 12: Elektrolytische Raffination von Kupfer
Umweltverschmutzungen durch Kupferhütten, die sulfidische Erze nach diesem "klassischen" Verfahren verarbeiten, waren in der Vergangenheit üblich. So emittierte eine Kupferschmelze in Butte Anaconda (USA) bereits 1907 täglich 18 t Arsen, 1,7 t Kupfer und fast ebensoviel Antimon. (Über den Schwefeldioxidausstoß wird nichts berichtet.) Die Emissionen einer anderen Hütte in Kalifornien verseuchten 2.300 km2 Land mit Arsen.
Auch bei Emissionsminderung durch Abgasentstaubung entstehen bei der pyrometallurgischen Cu-Gewinnung erhebliche Mengen Schlacke und Schwefeldioxid.
Das bei der Verhüttung der Kupfererze anfallende Schwefeldioxid wird heute üblicherweise zur Schwefelsäureherstellung verwendet.
Das klassische hydrometallurgische (nasschemische) Verfahren
Der schwefelsaure Extrakt der Erze wird mit Eisenschrott versetzt,
wobei das Eisen in Lösung geht und das edlere Kupfer zum Metall
reduziert wird:
Bei diesem Zementation genannten Prozess besteht der Nachteil darin, dass
| - | zusätzlich elementares Eisen benötigt wird, |
| - | die Schwefelsäure bei mehrmaliger Verwendung mehr und mehr verdünnt und neutralisiert wird, |
| - | sich Eisen(II)-sulfat ("Grünsalz" FeSO4 · 5 H2O) anreichert. |
Zudem muss das erhaltene Kupfer in einem anschließenden Schritt durch Raffinationsschmelzen vom größten Teil der bekannten Verunreinigungen befreit werden. Erst dann kann es durch Elektrolyse zu Reinstkupfer verarbeitet werden.
Selektiver Ionenaustausch als modernes Verfahren
Zunächst wird, wie bei dem oben beschriebenen Prozess, das
Kupfererz mit Schwefelsäure behandelt. Die erhaltene Lösung wird
mit einem wasserunlöslichen komplexierenden Ionenaustauscher,
der in hochsiedenden Kohlenwasserstoffen gelöst ist, extrahiert. Die
dabei ablaufende Reaktion ist am Beispiel des 2-Hydroxy-5-dodecyl-benzophenoxims gezeigt
(-> Abb.13). Durch die selektive
Wirkung des Austauschers werden der wässrigen Phase dabei nur
die Kupfer-Ionen entzogen und gegen Protonen ausgetauscht. Die
vom Kupfer befreite Schwefelsäure wird erneut zum Aufschluss von
frischem Erz verwendet.
Der mit Kupfer-Ionen beladene Ionenaustauscher wird mit höherkonzentrierter Schwefelsäure gewaschen. Dabei werden die Kupfer-Ionen in die Säurephase überführt. Der Ionenaustauscher liegt danach wieder in der Wasserstoffform vor. Aus der gewonnenen schwefelsauren Kupfersulfatlösung wird das Kupfer elektrolytisch abgetrennt. Die hinterbleibende Schwefelsäure dient wieder zur Regeneration von beladenem Ionenaustauscher.
Es wird deutlich, dass im Gegensatz zum klassischen Verfahren keine schädlichen Abgase wie Schwefeldioxid entstehen. Außerdem lassen sich auch gering konzentrierte Kupfererze sowie Haldenmaterial gewinnbringend aufarbeiten.
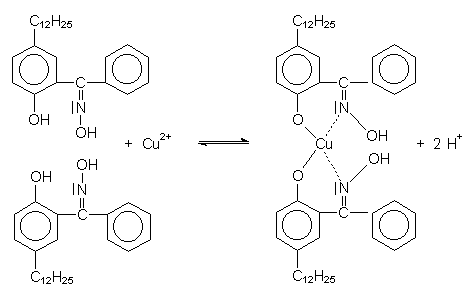
Abb. 13: Beispiel für einen löslichen Ionenaustauscher zur Kupfergewinnung
Mikrobiologisches Erzleaching
Heute impft man Halden mit Bakterien, die das Kupfer aus Abraumhalden
herauslösen und als Sulfat anreichern. Man braucht die
Halden nur mit Nährlösung zu besprühen, die ablaufende Lösung
von Kupfersalzen aufzufangen und wie eben besprochen abzutrennen.