
Tab. 3: Vergleich der Eigenschaften von Aluminium und Eisen
5.4.2 Gewinnung und Verwendung von Aluminium
Aluminium Al ist ein weit verbreitetes Leichtmetall von hoher technischer Bedeutung. Es ist zwar wesentlich unedler als Eisen, überzieht sich aber mit einer nur wenige Nanometer dicken Oxidschicht, die das Metall vor weiterem Angriff schützt (Passivierung). Diese Oxidschicht kann auch durch Elektrolyse in oxidierender Lösung verstärkt werden (Eloxierung). Aluminium ist der Grundstoff der Flugzeugindustrie.
Die Bedeutung von Aluminium wird deutlich im Vergleich zu Eisen (-> Tab. 3).
Die Schmelzelektrolyse von Aluminiumoxid
Die Aluminiumgewinnung gehört noch immer zu den Verfahren,
durch die große Umweltschäden verursacht werden können. Denn der
Aufwand an Energie und Material sowie die Emission von Schadstoffen
sind beträchtlich.
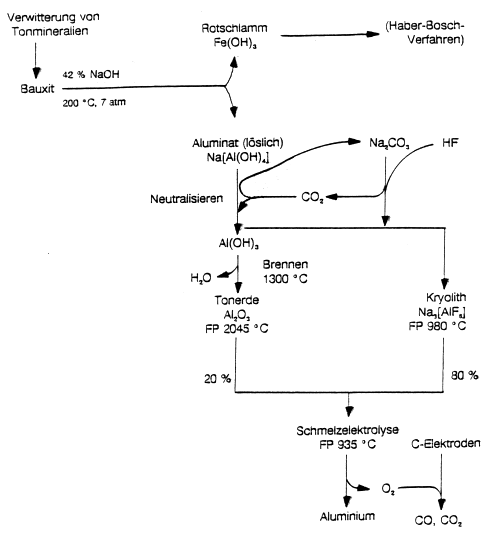
Die Abb. 14 zeigt ein Flussdiagramm der Gewinnung des Leichtmetalls aus dem Rohstoff Bauxit.
Die Besonderheit bei der Gewinnung von Aluminium ist, dass das Oxid einer Schmelzelektrolyse unterworfen werden muss. Grund ist, dass das Metall mit den anderen Reduktionsmitteln wie Kohlenstoff oder Wasserstoff Verbindungen (Carbide, Hydride) eingeht, die gegenüber Wasser äußerst instabil sind. (Dagegen ist Eisencarbid ein wichtiger Bestandteil von Stahl.)
Die chemische Reaktion bei der Schmelzelektrolyse ist die Umkehrung der Oxidation von Aluminium:

Tab. 3: Vergleich der Eigenschaften von Aluminium und Eisen
| Eigenschaft | Al | Fe |
|---|---|---|
| Dichte (g/cm3 | 2,7 | 7,86 |
| Schmelzpunkt (°C) | 660 | 1535 |
| Mechanische Eigenschaften | weich, duktil (verformbar) | weich |
| Folien | 0,004 mm | keine |
| Standardpotential
(sauer/basisch) |
-1,66/-2,33 Volt | -0,40/-0,88 Volt |
| Oxidschicht | 5 nm, fest haftend | blätternd, Rost |
| Legierbarkeit
- mit Leichtmetallen - mit Schwermetallen |
sehr gut
mit Ti, Mg nur mit Cu |
sehr gut
nur mit Ti nicht mit Cu |
| Elektrische Leitfähigkeit
(bezogen auf Cu) |
65 % | 15 % |
| Wärmeleitfähigkeit
(bezogen auf Cu) |
60 % | 15 % |
| Schweißbarkeit | nur unter
Luftabschluss |
auch bei
Luftzutritt |
Bei Start der Elektrolyse wird künstlicher Kryolith Na3[AlF6] im deutlichen Überschuss zugesetzt. Er dient nicht nur zur Erniedrigung des Schmelzpunktes von Aluminiumoxid, sondern spielt auch eine katalytische Rolle.
Bilanz der Gewinnung von 1 t Aluminium:
- Rohstoffe:
| - | 4 000 kg Bauxit, |
| - | 150 kg Natriumhydroxid, |
| - | 20 kg Aluminiumfluorid, |
| - | 485 kg Kokselektroden. |
- Energieverbrauch:
| Theoretischer Verbrauch:
1 t Aluminium entspricht 37 065 Mol Al. Pro Mol benötigt man 0,835 MegaJ an Reduktionsenergie. Die Grundmenge an Energie ist also 30 950 MegaJ/t Al. |
| Tatsächlicher Verbrauch: | 123 600 MegaJ, |
| - Abtrennen von Al(OH)3 | 39 200 MegaJ Dampfwärme, |
| - Brennen von Al(OH)3 | 17 200 MegaJ Heizgas, |
| - Elektrolyse von Al2O3 | 67 000 MegaJ elektr. Strom, |
| - Sintern von Kokselektroden | 200 MegaJ. |
Zum Energieaufwand sei aus einem Brief des Gesamtverbands
der Aluminiumindustrie e. V. (Stand 13.11.02) zitiert:
"Zur Herstellung von Aluminium werden: 1,3 t Braunkohle, 1,4 t Steinkohle, 0,4 t Gas, 1,4 t Öl,
sowie 2,6 mWh Energie aus Kernkraft sowie 8,3 mWh Energie aus Wasserkraft benötigt." Ob das Gesamtangaben
oder Alternativen sind, wird nicht ganz klar.
Denn an anderer Stelle heißt es zur Herkunft der Energie: "Rund 52 % der Energieversorgung zur
Herstellung von Primäraluminium wird derzeit aus Wasserkraft gewonnen (weltweit), 15 % aus Kernkraft
und 20 % aus Steinkohle. Die verbleibenden 13 % werden aus Öl, Gas und Braunkohle gewonnen. Die Assoziation,
Kernkraft wäre die entscheidende Energiequelle zur Herstellung von Aluminium ist daher falsch."
Diese Assoziation kam wohl auf, als vor einiger Zeit zufällig neben dem neu erbauten Kernkraftwerk in Stade bei Hamburg gleichzeitig zwei große Aluminiumwerke gebaut wurden. Dazu zitieren wir aus der Internetwebseite der Stadt Stade (Stand Nov. 2002):
|
"Neben den wichtigsten Standortvorteilen - der Lage am Weltschifffahrtsweg Elbe und verfügbaren Arbeitskräften - ist entscheidend, dass durch das 1972 ans Netz gehende Kernkraftwerk billige Energie zur Verfügung stellt (soll wohl "steht" heißen; R. B.). Nachdem (...), siedeln sich hier nun (...) bedeutende Großunternehmen an. (...). Die VAW (Vereinigte Aluminiumwerke) bauen eine Aluminiumhütte und ein Werk zur Herstellung von Aluminiumoxyd." |
Umweltbelastungen bei der Aluminium-Gewinnung und Gegenmaßnahmen
| 1. | Landschaftsschäden bei der Bauxitgewinnung. Dem Vernehmen nach wird rekultiviert - auch in Entwicklungsländern. |
| 2. | Der basische Rotschlamm muss deponiert werden. Ein kleiner Teil findet als Katalysator bei der Ammoniaksynthese nach Haber-Bosch Verwendung. |
| 3. | Energieverbrauch.
Obgleich heute fast die gesamte kalorische Energie recycelt wird, ist die Abwärme bei der Energieumwandlung zu bedenken. |
| 4. | Bei der Elektrolyse lässt sich die Freisetzung von Fluor und Fluorwasserstoff nicht vermeiden. Diese schädigen Pflanzen und Tiere in der Nähe von Aluminiumfabriken. Dem Vernehmen nach "werden Fluoride zu mehr als 99% gefiltert". Sie werden im Kreislauf geführt und in Form von AlF3 wieder in die Elektrolysezelle gegeben. |
| 5. | Freisetzung von CO und CO2. Diese sind wichtige atmosphärische Spurengase. |
| 6. | Aluminium-Ionen sind vor allem für Mikroorganismen im Boden toxisch. Sie sind in großen Mengen aber auch pflanzen- und tiertoxisch. |
Recycling von Aluminium
Aus den genannten Gründen ist das Recycling von Aluminium anzustreben. Recyceltes Aluminium
hat dem Vernehmen nach die gleichen Eigenschaften wie frisch hergestelltes und ist genauso hochwertig,
ist aber erstaunlicherweise (wenn auch nur um 10 %) billiger. Hier geht es wohl um Betriebsrecycling,
also um Material, das während der Verarbeitung sortenrein anfällt. Zum Recycling von verschmutztem
oder legiertem Aluminium sowie von Getränkedosen der Eisen/Alu-Kombination haben wir beim o. a.
Verband nachgefragt; darüber berichten wir später.