
5.4.3 Gewinnung und Verwendung von Titan
Titan ist ein Leichtmetall mit der Dichte von 4,5 g/cm3 und dem recht hohen Schmelzpunkt von 1677 °C. Es steht zwar an 10. Stelle in der Elementhäufigkeit der Erdkruste und ist damit häufiger als Chlor, Phosphor oder Kohlenstoff (-> Tab. 4), tritt aber sehr weit zerstreut und deshalb nur selten in größeren Erzlagerstätten auf. Titanerze sind vor allem Rutil TiO2 oder Ilmenit FeTiO3 aus Norwegen.

| Tab. 4: |
Häufigkeit der Elemente in der Erdkruste (Lithosphäre)
(Angaben in Massenprozenten) |
| Sauerstoff | 50.50 | Phosphor | 0.07 |
| Silicium | 27.50 | Fluor | 0.07 |
| Aluminium | 7.30 | Mangan | 0.06 |
| Eisen | 3.38 | Schwefel | 0.05 |
| Calcium | 2,79 | Barium | 0.05 |
| Kalium | 2.58 | Strontium | 0.05 |
| Natrium | 2.19 | Zirkon | 0.01 |
| Magnesium | 1.29 | Rubidium | 0.01 |
| Wasserstoff | 1.02 | ———— | |
| Titan | 0.43 | 0.35 Gew.-% | |
| Stickstoff | 0.33 | ||
| Chlor | 0.19 | ||
| Kohlenstoff | 0.12 | ||
| ———— | |||
| 99.62 Gew.-% |
Die übrigen ca. 80 Elemente machen nur noch 0,03 % aus.
Bedeutung von Titan
Titan (Dichte 4,5 g/cm3, Schmelzpunkt 1677 °C) ist von hervorragender
technischer Bedeutung. Beispiele hierfür sind:
| - | Flugzeugbau.
Titan ist ein leichtes, dabei aber äußerst zähes Metall. Es ist mit vielen Metallen legierbar. Legierungen wie die Titanstähle sind besonders zäh und hochtemperaturstabil. Titan und Titanstähle werden an hochbelasteten Stellen eingebaut (z. B. Scharniere bei Hochleistungsflugzeugen mit Schwenkflügeln wie der B-1B, Titanwanne für den A-10-Piloten). Zu den Grenzen des Einsatzes von Titan im Turbinenbau siehe unsere Extrawebseite. |
| - | Farbpigmente auf der Basis von Titandioxid TiO2.
Als Mineral Rutil hat Titandioxid einen Brechungsindex vergleichbar mit dem von Diamant. Das technische TiO2 wird in verschiedenen Zubereitungen als Anstrichfarbe oder Pigment für Kunststoffverkleidung von Fenstern, Küchenmöbeln und Kaffeemaschinen gebraucht (Titanweiß). |
| - | Titan-Tetrachlorid TiCl4 ist eine wichtige, katalytisch wirkende Lewissäure für organische Synthesen. Besonders bei Friedel-Crafts-Synthesen, Substitutionen an Aromaten, spielt es eine große Rolle. |
Gewinnung von Rohtitan
Der Aufschluss der Erze erfolgt mit konzentrierter Schwefelsäure,
wobei Eisen(II)- und Titansulfate entstehen. Die Oxidation von Fe2+ zu
Fe3+ wird durch Zugabe von Eisenschrott verhindert, da sich sonst
bei weiterer Verarbeitung Eisen(III)-hydroxid bildet und den farblich
hochsensiblen Titanhydroxid-Niederschlag verunreinigt. Aus der
Aufschlusslösung wird gelöstes Eisen(II)-sulfat FeSO4 · 5 H2O
abgetrennt, welches teilweise als Flockungsmittel
("Grünsalz") an Klärwerke geht. Nach Abtrennung wird TiO2
bei 1200 °C in Drehöfen gebrannt.
Die Reduktion erfolgt mit Wasserstoff oder Calciumhydrid:
Eine andere Reaktionsmöglichkeit führt zuerst zum Titanchlorid:
Dieses wird entweder als Lewissäure weiterverwendet oder mit metallischem Natrium reduziert:
Natrium wird aufwendig durch Schmelzelektrolyse von Natriumchlorid hergestellt (-> 5.5.1).
Raffinieren von Titan
Ohne extreme Raffination sind die mechanischen Eigenschaften von
Titan nicht kalkulierbar. Deshalb sind hierfür - wie auch für andere
hochwertige, in höchster Reinheit gewünschte Elemente wie
Silicium, Germanium und Wolfram, Zirkonium, Vanadium oder
Molybdän High-Tech-Verfahren entwickelt worden. Einige Beispiele:
Aufwachsverfahren (Van Akel-de Boer-Verfahren)
Bei diesem Verfahren (-> Abb. 15) werden Metalle durch thermische
Zersetzung flüchtiger Halogenide hochgereinigt. Titanpulver reagiert
im geschlossenen System in einer Iodatmosphäre bei 500 °C unter
Bildung von Titan-Tetra-Iodid:
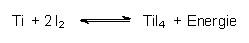
Das entstandene Titan-Iodid verdampft und diffundiert zu einem 1200 °C heißen Titan-Draht, wo es in der Umkehrreaktion zerfällt. Das Metall schlägt sich dabei nieder. (Analog funktionieren Halogenlampen.)
Zonenschmelzverfahren
Über einen gesinterten Rohmetallstab führt man langsam eine
Induktionsschleife, mit dem man das Metall in einer schmalen Zone
bis zum Schmelzpunkt hoch aufheizt (-> Abb. 16). Hinter der
Schmelzzone kristallisiert das Material wieder aus, allerdings
hochrein, weil die Verunreinigungen in der Schmelze bleiben. Mit
Fortschreiten der Schmelzzone wird die Schmelze immer reicher an
Verunreinigungen. Zum Schluss trennt man durch Zonenschmelzen
das abgekühlte Ende des Stabes einfach ab. Man erreicht Reinheiten
von 1:1012. Dieses Verfahren wird auch bei der Raffination
von Halbleitermaterial wie Silicium oder Germanium angewendet.
Elektromigration (Abb. 17)
Im Hochvakuum wird ein gesinterter Titanstab zwischen zwei
Kupfer-Elektroden befestigt und elektrisch auf genau 1620 °C,
knapp unter dem Schmelzpunkt, erhitzt. Die Verunreinigungen
wandern gemäß ihrer Elektronegativität (EN) zum (+)- oder
(-)-Pol.
Dabei bilden die im Vergleich zu Titan stärker elektronegativen
Metalle Anionen (Me¯), die geringer elektronegativen
Metalle eher Kationen (Me+). Das Titangitter
bleibt zurück.
Die die Verunreinigungen tragenden Endstücke werden abgesägt.
Umweltschäden bei der Titangewinnung
Neben dem hohen Energieaufwand ist vor allem der Schwefelsäureabfall
("Dünnsäure") bedenklich: Bei der Herstellung von 1 t
TiO2 entstehen 7 - 8 t Dünnsäure (-> 5.2).
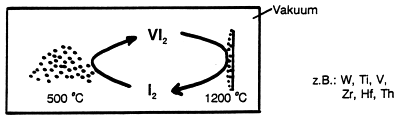
Abb. 15: Van Akel-de Boer-Verfahren
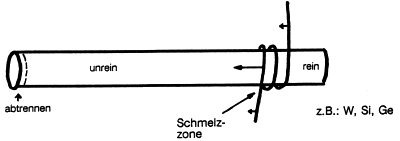
Abb. 16: Zonenschmelzen
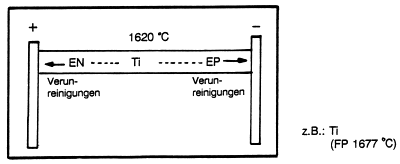
Abb. 17: Elektromigration