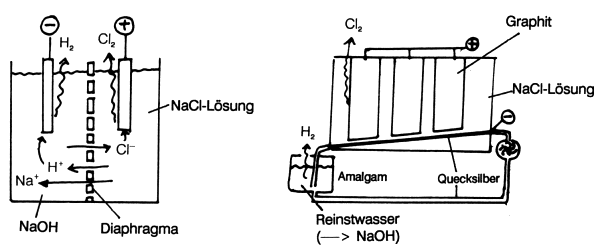
Abb. 18 (links): Diaphragmaverfahren Abb. 19 (rechts): Amalgamverfahren |
5.5 Verfahren zur Elektrolyse von Natriumchlorid
Eine der wichtigsten Grundchemikalien ist die Natronlauge, die wässrige Lösung von Natriumhydroxyd NaOH. Gleiches gilt auch für das Metall Natrium. Letzteres benötigt man z. B. zur organisch-chemischen Synthese (man denke an die Kunststoffbezeichnung Buna - zusammengesetzt aus Butadien, das unter der Einwirkung von Natrium zu Kunstkautschuk polymerisiert), als Reduktionsmittel oder als Kühlmittel in Kernkraftwerken.
Natronlauge benötigte man in großen Mengen zuerst zur Herstellung von Regeneratcellulose (Viskose, Reyon). Heute dient es als Neutralisationsmittel, Verseifungschemikalie usw. In reinem Zustand ist sie sogar auch in Haushaltschemikalien enthalten (Rohrfrei). Natriummetall ist sehr unedel. Es ist daher ein wichtiges Reduktionsmittel und Starter von Polymerisationen (Buna; -> 5.12.2).
Es war bald notwendig, eine billige Synthese für Natrium und Natronlauge zu finden. Man greift heute auf das billige und leicht zu reinigende Steinsalz (Natriumchlorid NaCl, Kochsalz) zurück. Weltweit stellt man daraus jährlich 37 Mio. t Natriumhydroxid und 33 Mio. t Chlor her.
Zwei Formen der Elektrolyse von Natriumchlorid sind denkbar: die Schmelzelektrolyse und die Elektrolyse von wässrigen Lösungen.
5.5.1 Schmelzelektrolyse
Die chemische Reaktion ist:
Als Elektroden dienen Eisen oder Graphit. Um die Rückreaktion zu verhindern, werden Reduktion und Oxidation in getrennten Räumen vorgenommen. Ein Problem ist der hohe Schmelzpunkt von Natriumchlorid. Dieser kann durch Zusatz von Calciumchlorid von 801 °C auf ca. 600 °C gesenkt werden. Da Calcium unedler ist als Natrium, wird es nicht abgeschieden.
5.5.2 Elektrolyse von wässrigen NaCl-Lösungen
Die Gesamtgleichung der Elektrolysereaktion ist:
Bei der Elektrolyse geht man stets vom Gemisch Na+, Cl¯, H+, OH¯ aus. (Letztere stammen aus dem Dissoziationsgleichgewicht des Wassers.) Die Art der Produkte neben dem Chlor hängt vom Elektrodenpotential der Kathode ab. Beim Diaphragmaverfahren scheidet sich an Eisen Wasserstoff, beim Amalgamverfahren an Quecksilber Natrium ab.

Abb. 18 (links): Diaphragmaverfahren Abb. 19 (rechts): Amalgamverfahren |
A. Diaphragmaverfahren
Hierbei elektrolysiert man eine konzentrierte NaCl-Lösung in getrennten
Räumen, die durch ein Diaphragma (eine Membran aus
keramischem Material oder Asbest) ionendurchlässig verbunden
sind. An der Graphitanode bildet sich Chlor:
An der Eisenkathode bildet sich Wasserstoff:
Die Wasserstoff-Ionen stammen aus der Eigendissoziation des Wassers:
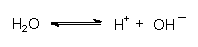
Entfernt man H+-Ionen aus diesem Gleichgewicht, so verschiebt es sich unter ständigem Verbrauch von H2O und Bildung von OH¯-Ionen.
Warum scheiden sich nicht Natrium- oder Hydroxid-Ionen ab? Die Abscheidungsspannung für Natrium ist wesentlich höher als für Wasserstoff. Gleiches gilt für den Sauerstoff, der sich aus OH¯-Ionen bilden könnte.
Man muss wissen, dass wie alle chemischen Reaktionen auch Elektrolyse-Vorgänge gehemmt werden können. Zur Überwindung der Reaktionshemmung bedarf es einer Aktivierungsenergie. Dies bedeutet Mehraufwand an elektrischer Spannung (Überspannung). Eisen (wie auch die anderen Elemente der 8. Nebengruppe, Nickel und die Platinmetalle) aktiviert Wasserstoff, d. h. diese Elemente katalysieren die Kathodenreaktion. Der Grund ist, dass diese Metalle den Wasserstoff geradezu lösen oder schwammartig aufsaugen.
Bei diesem Verfahren erhält man folglich Wasserstoff, Chlor und Natronlauge. Die NaOH ist allerdings maximal nur 5prozentig, weil dann die Sauerstoffbildung aufgrund des Konzentrationseffekts (Entladung von OH¯-Ionen) beginnt. Die Natronlauge ist zusätzlich mit Natriumchlorid verunreinigt. Dieses fällt - weil relativ schwerlöslich - beim Eindampfen jedoch fast quantitativ aus.
B. Amalgamverfahren
Hier erzwingt man mit Hilfe von Elektroden aus Quecksilber die
Abscheidung von Natriummetall anstelle von Wasserstoff. Dies ist
möglich, weil Wasserstoff an Quecksilber eine sehr hohe Überspannung
zeigt. Dagegen scheidet sich Natrium besonders leicht ab,
weil es sich anschließend sofort im Quecksilber unter Amalgambildung löst.
Bei diesem Verfahren läuft in 14 m langen und 0,6 m breiten Trögen über eine schwache Schrägung eine 6 mm dicke Quecksilberkathode, über der in 4 mm Abstand große Graphitanoden angeordnet sind. Das Quecksilber reichert sich zunehmend mit Natriummetall an (max. 0,2 %) und gelangt anschließend in einen Raum mit hochreinem Wasser. Hier reagiert das Natrium zu Wasserstoff und Natronlauge:
Die so erhaltene Natronlauge ist 50-60proz. und hochrein. Sie wird anschließend eingedampft.
Vergleicht man die drei Verfahren, so stellt man fest, dass letztlich die gleichen Produkte erhalten werden. Nur ist der Reinheitsgrad unterschiedlich.
C. Membranverfahren
Anstelle von Asbestdiaphragmen setzt man Kationenaustauschermembranen
auf Teflonbasis (-> Abb. 19a) ein. Diese lässt nur Na+-Ionen
passieren. Am (-)-Pol elektrolysiert man reines Wasser, das
sich zunehmend mit Na+ aus dem Anodenraum anreichert. Die
erhaltene Natronlauge ist völlig rein. Das Membranverfahren ist somit eine
erfolgversprechende Alternative zum Amalgamverfahren.
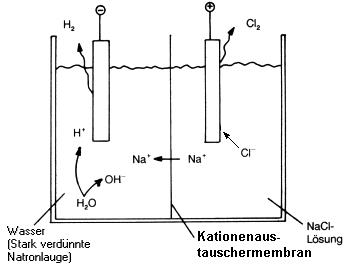
Abb. 19a: Membranverfahren
| 5.5.3 |
Chlor und Wasserstoff als Koppelprodukte bei der
NaOH-Gewinnung |
Koppelprodukte sind im allgemeinen - wie bei der Phenolsynthese nach Hock (-> 5.10.2) - ökonomisch interessant. Dies gilt sicherlich für den Wasserstoff, weniger aber für das Chlor.
1. Wasserstoff ist ein vielfältig verwertbares Produkt. Zunächst dient es in diesem Zusammenhang zur Herstellung von Chlorwasserstoff und Salzsäure. Dazu verbrennt man Wasserstoff in einer Chloratmosphäre:
Der gebildete Chlorwasserstoff wird in Wasser eingeleitet und reagiert hier zu Salzsäure. Deren maximale Konzentration ist ca. 35 %.
Weiter benötigt man Wasserstoff als Reduktionsmittel in der Metallurgie (-> 5.4) oder in der organischen Synthese (-> 5.9.4). Wichtig ist auch die Addition von Wasserstoff an ungesättigte Verbindungen wie z. B. bei der durch Nickel katalysierten Fetthärtung. In der Umwelttechnologie spielt Wasserstoff eine große Rolle bei der katalytischen Druckentschwefelung (-> 4.1). Auch als Reduktionsmittel zum Betrieb von Brennstoffzellen findet er Verwendung. Der große Tank der Weltraumfähren enthält ebenfalls zum größten Teil flüssigen Wasserstoff (Challenger-Unglück).
2. Trockenes Chlor greift Eisenflaschen nicht an (Korrosion setzt die Anwesenheit von Wasser voraus). Deshalb wird Chlorgas mit konzentrierter Schwefelsäure getrocknet. Erst wenn der Wasseranteil kleiner als 3 g pro 100 kg Chlor ist, ist es sinnvoll, das Chlorgas zu verflüssigen (SP: —45 °C bei 1 atm).
Chlor löst sich aber auch in Wasser bzw. in der Elektrolyselösung. Dabei bilden sich Salzsäure HCl und unterchlorige Säure HClO:
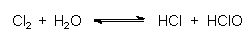
Das Gleichgewicht verschiebt man durch Ansäuern - logischerweise mit HCl-Gas - nach links. Das Ausgasen von Chlor wird durch Anlegen von Unterdruck gefördert.
5.5.4 Umweltschäden bei der Elektrolyse von Natriumchlorid
Neben dem Energieaufwand, vor allem zur Überwindung der Überspannung, ist die mögliche Kontamination der Umwelt mit Quecksilber zu nennen. Deshalb arbeitet man an neuen Prozessen, wie dem Membranverfahren, bei denen man ohne dieses giftige Metall auskommt.
Bedenklich ist auch die mögliche, auch unfallbedingte Emission von Chlor. Chlor ist als starkes Oxidationsmittel und Säurebildner schon in sehr geringer Konzentration ein Lungengift, das schon in ppm-Konzentrationen Atemnot und Panik auslöst. Man muss deswegen vorsichtig damit umgehen. Die meisten chemischen Unfälle, die gemeldet werden, haben mit Chlorgas zu tun. Klassisch ist der Bademeisterunfall.
In diesem Zusammenhang ist auf die Schwierigkeit hinzuweisen, Koppelprodukte loszuwerden. Was macht man eigentlich mit den großen Mengen an Chlor, die bei der Herstellung des wesentlich gewünschteren Produkts Natronlauge anfallen?
Eine makabere Art und Weise der Entsorgung hat der spätere Nobelpreisträger Haber (Ammoniaksynthese; -> 5.3.2) im Verlauf des ersten Weltkriegs eingeführt: Er bewog 1915 die ihm eng verbundene deutsche Heereskriegsleitung, mit den in seiner Firma herumstehenden Tausenden an Chlorgasflaschen den Gaskrieg zu eröffnen.
Heute hat man den Eindruck, dass die chemische Industrie Chlor entsorgt, indem sie riesige Mengen an chlorierten Produkten herstellt. Man denke an chlorierte Kohlenwasserstoffe (CKW, FCKW), an nichtflüchtige Pestizide (DDT, Atrazin, Lindan, Toxaphen usw.), aber auch an Kunststoffe wie PVC.
Die Bedeutung der PVC-Synthese zur Chlorentsorgung mag folgende Rechnung zeigen. PVC ist wie folgt aufgebaut:
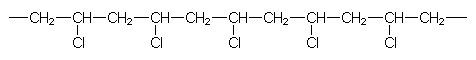
Die Massenverhältnisse der Elemente in den Bausteinen
(-CH2-CHCl-) sind
Man muss jedoch darauf hinweisen, dass Chlor hauptsächlich zur Herstellung von Intermediärverbindungen dient, da es leicht zu substituieren ist. Das ist z. B. bei der Synthese von Kunststoffen auf Phosgenbasis wie den Polycarbonaten der Fall.