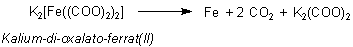
Versuch: Pyrophores Eisen
Schülerversuch; 15 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Grundlagen
Zunächst wird Eisen(II)-oxalat hergestellt.
Fe2+ + (COO)22- ———> Fe(COO)2
Dieses zersetzt sich in der Hitze in einer Redoxreaktion zu Eisen und CO2.
Fe(COO)2 ———> Fe + 2 CO2
Genau genommen handelt es sich bei diesem "Eisen(II)-oxalat" um eine Komplexverbindung, Kalium-di-oxalato-ferrat(II). Diese reagiert beim Erhitzen analog:
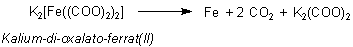
Geräte
Reagenzgläser, Messzylinder oder Pipette (10 ml), Erlenmeyerkolben (25 ml),
Wattebausch oder passende Gummistopfen, Filtriervorrichtung.
Chemikalien und Material
Kaliumoxalat (Xn), Eisen(II)-sulfat (Xi), destilliertes Wasser.
Durchführung
1 Darstellung von Kalium-di-oxalato-ferrat(II)
Ein Reagenzglas wird etwa 1 cm hoch mit Kaliumoxalat gefüllt. In das andere Glas
gibst du die gleiche Menge an frischem Eisen(II)-sulfat. Beide Salze löst du in je 10 ml
destilliertem Wasser. Nicht versuchen, die beiden Salze simultan zu
lösen!
Danach gießt du beide Lösungen in einen kleinen Erlenmeyerkolben zusammen,
vermischt gut und lässt einige Minuten stehen.
Zunächst bildet sich eine intensiv orangefarbene Lösung, dann der gelbe Niederschlag aus
dem gewünschten schwerlöslichen Komplexsalz. Etwas warten; das erhöht die Ausbeute!
Filtriere den Niederschlag ab, spüle ihn mit destilliertem Wasser und trockne ihn.
2 Demonstration von pyrophorem Eisen
Das Reagenzglas mit dem gelben, getrockneten Eisen(II)-oxalat-Niederschlag aus dem ersten
Versuchsteil wird mit einem Wattebausch locker verschlossen. Dann wird es mit dem Bunsenbrenner
zunächst vorsichtig erhitzt, bis das gelbe Pulver anfängt, sich an einigen Stellen zu schwärzen.
Beobachtet, wie sich das CO2 bildet! Die Masse scheint richtig zu leben... Dann erhitzen
wir weiter, bis der Niederschlag völlig schwarz geworden ist.
Wichtig: Nach dem Beenden des Erhitzens wird das noch heiße Glas sofort mit einem Gummistopfen
verschlossen, damit beim Abkühlen keine Luft eindringen kann.
Nun dunkelst du den Raum völlig ab, hältst das Reagenzglas mit der Öffnung schräg nach unten, öffnest das Glas und gießt das schwarze Pulver auf den Kacheltisch oder auf eine andere feuerfeste Unterlage. (Pyrophores Eisen muss übrigens zur Demonstration seiner Reaktivität nicht heiß sein; es reagiert auch in der Kälte.) Du beobachtest, dass das Eisenpulver bei Kontakt mit der Luft hell aufglüht. Wir sehen deshalb einen wahren Funkenregen, der sich nach unten ergießt. Es verwandelt sich dabei in rotes bis schwarzes Eisenoxid.
3 Aufbewahren von pyrophorem Eisen
Hast du das Glas nach dem Erhitzen sofort mit einem Gummistopfen verschlossen, damit beim Abkühlen
keine Luft eindringen kann, kannst du das Pulver ein paar Tage aufbewahren.
Du kannst das Reagenzglas vor der Herstellung des pyrophoren Eisens auch zu einer Ampulle
ausziehen und diese nach der Herstellung des Eisenpulvers samt Inhalt sofort durch Zuschmelzen verschließen.
Quelle
nach H. Keune, W. Filbry: Chemische Schulexperimente, Band 2: Anorganische
Chemie I, Volk und Wissen, Berlin 1985.