
Warum Autos und Brücken rosten: Korrosion
Experimente:
Versuch: Modellversuche zur katalysierten Säurekorrosion
Versuch: Pyrophores Eisen
Versuch: Vom Lokalelement zum Voltaelement
Versuch: Eisen(II)-hydroxid wird durch Luft leicht oxidiert
Versuch: Unter welchen Bedingungen Eisen rostet
Versuch: Eisen rostet in Leitungswasser schneller als in Mineralwasser
Versuch: Was beim Rosten passiert
Grund für die riesige Weltproduktion von Eisen ist nicht die ständige
Neukonstruktion von Anlagen, sondern Ersatz für korrodierte Bauteile. Dass das
stimmt, weißt du, wenn du bedenkst, wie oft du oder dein Vater ein neues Auto kaufen
musst, weil die Roststellen nicht mehr zu übersehen sind und der TÜV-Prüfer
eine bedenkliche Miene zeigt...
Wie unedel Eisen ist, zeigt die leichte Entzündbarkeit von feinstverteiltem Eisen, dem
so genannten "Pyrophoren Eisen" (-> Versuch). In der
Trockenheit ist Eisen jedoch völlig stabil. Auch konzentrierte Schwefelsäure oder
Salpetersäure machen dem Eisen nichts aus. Denn es liegt passiviert vor, also mit einer
dünnen, wenn auch wenig stabilen Oxidschicht vor weiterem Angriff geschützt. Aber
Spuren von Wasser (auch nur als Luftfeuchtigkeit) lassen Eisen rasch rosten
(-> Versuch).
Korrosion ist die chemische Reaktion eines Metalls mit Chemikalien aus seiner Umgebung in Gegenwart von Wasser
Korrosion ist ein Redoxphänomen
| - | Akzeptor Wasserstoff-Ionen: Säurekorrosion |
| - | Akzeptor Sauerstoff/Wasser: Sauerstoffkorrosion |
Korrosionsprozesse sind eng mit elektrochemischen Prozessen verbunden
Förderlich für Korrosion von Eisen sind neben Wasser Kontakte mit

Bild 1: Streusalz fördert die Korrosion des Gullydeckels
(Foto: Blume)
Säurekorrosion
Hierunter versteht man zunächst die Auflösung eines Metalls durch eine
Säure (-> Versuch).
Fe + 2 HCl ———> FeCl2 + H2
Dies ist ein Redoxprozess zwischen Eisen und Wasserstoff-Ionen:
Oxidation: Fe ———> Fe2+ + 2 e-
Reduktion: 2 H+ + 2 e- ———> H2
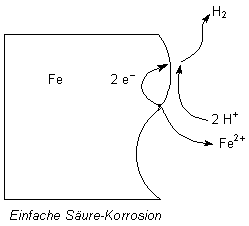
Dieser Prozess ist aber gehemmt. Grund ist, dass sich das Eisenstück rasch mit positiv
geladenen Ionen überzieht, die weitere Wasserstoff-Ionen nicht an die
Metalloberfläche gelangen lassen. Wir sehen deshalb in unserem Versuch, dass auch
eine 0,5 M Schwefelsäure kaum reagiert.
Gibt man aber Kupfer-Ionen hinzu, beginnt die Bildung von Wasserstoff
augenblicklich. Das riecht förmlich nach Katalyse. Was ist los?
Kupfer schlägt sich in der bekannten Zementierungsreaktion auf Eisen nieder und
bildet Lokalelemente:
Cu2+ + Fe ———> Cu + Fe2+
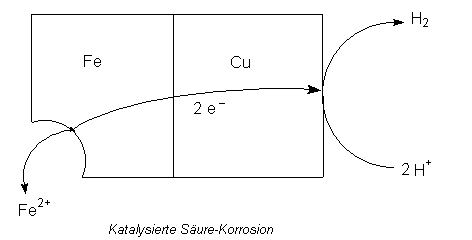
Betrachten wir nun die Korrosion eines Systems aus Eisen, Kupfer und Wasser (-> Versuch). Kupfer katalysiert die Korrosion, weil es als stärker elektronegatives Element Elektronen aus Eisen anzieht. An der an Elektronen reichen Cu-Oberfläche werden Wasserstoff-Ionen unter Bildung von Wasserstoff entladen:
Damit entfällt die hemmende Wirkung der Bildung von Eisen(II)-Ionen auf die Entladung von Wasserstoff-Ionen. Die positiven Überschussladungen am Eisen werden nun problemlos als Fe2+-Ionen abgegeben; das Eisen korrodiert ungestört.
Dazu bedarf es aber keiner starken Säure. Es reicht das Wasser aus.
Denn das umgebende Wasser liegt teilweise dissoziiert vor und enthält deswegen Wasserstoff-Ionen: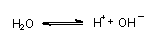
Die Wasserstoff-Ionen reagieren wie oben beschrieben auf der Metalloberfläche.
Auch hier wirkt Kupfer als Katalysator. Wegen der geringen Konzentration an
Wasserstoff-Ionen läuft die Korrosion allerdings relativ langsam ab, aber ist auf die
Dauer genauso effektiv...
Kräftig unterstützt wird die Zersetzung des Eisens durch Bildung von
Eisenhydroxiden mit den aus der Wasserdissoziation stammenden OH--Ionen.
Das folgende Bild zeigt die katalytische Wirkung von Kupfer.
| Klick mich an! |
 |
| Bild 2: Katalytische Wirkung von Kupfer auf die Korrosion von Eisen.
Die Metallstücke lagen jeweils 12 Stunden in Leitungswasser (Foto: Daggi) |
In diesem Zusammenhang ist es erstaunlich, dass man Werkstücke wie die im folgenden Bild
gezeigten Abfluss-Stöpsel herstellt und verkauft: Bei denen ist ein verchromte oder verzinkte Eisenschraube
mit einer Mutter aus Messing(!) versehen. Das sieht nach absichtlicher Korrosionsförderung aus…
| Klick mich an! |
 |
| Bild 3: Kontakt-Korrosion an Abfluss-Stöpseln.
Links: Neues Werkstück. Rechts: Korrosion nach einem Jahr Gebrauch. (Foto: Blume) |
Der Effekt der katalysierten Säurekorrosion ist übrigens die Grundlage der Technologie
galvanischer Elemente
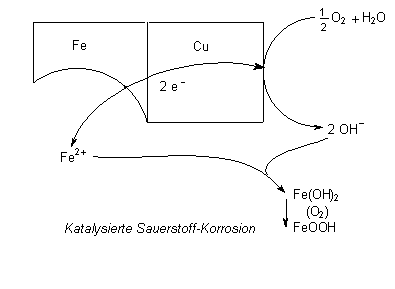
Sauerstoffkorrosion
Die Elektronen des Eisens können auch auf Sauerstoff und Wasser übertragen
werden.
Oxidation: Fe ———> Fe2+ + 2 e-
Reduktion: ½ O2 + H2O + 2 e-
———> 2 OH-
Dabei werden auch die Korrosionsprozesse fördernden OH--Ionen gebildet. In der Folge oxidiert der Sauerstoff Fe(II)-hydroxid weiter zu FeOOH (-> Versuch), dem gefürchteten Rost.
Rosten ist ein exothermer Vorgang
Weil die Korrosion im Allgemeinen so langsam abläuft, wird einem Beobachter gar nicht klar,
in welchem Umfang Energien freigesetzt werden. Dabei handelt es sich hier um die Oxidation
eines unedlen Metalls - zum Beispiel Eisen. Wie gut das brennt, zeigt ja das "Pyrophore Eisen"
(-> Versuch). Auf der bei der katalysierten Säurekorrosion
entwickelten Energie beruhen ja auch entsprechende galvanische Zellen wie zum Beispiel
das Voltaelement, in dem chemische Energie in elektrische
Energie umgewandelt wird.
In welchem Umfang beim Rosten auch Wärme frei wird, zeigten die Wärmekissen
der Bundeswehr. Deren Funktion beruht letztlich auf rasch ablaufender Sauerstoffkorrosion
mit deutlicher Rostbildung.
Rost ist voluminös
Der Rost hat den großen Nachteil, dass er ein viel größeres Volumen als das Eisen einnimmt
und dazu noch blättrige Schichten bildet. Liegt ein Eisenstück dazu noch im Boden, so bindet
der Rost zusätzlich Bodenmineralien, so dass auch vormals schlanke Eisenteile zu dicken Brocken
anwachsen können - wie der Nagel auf den nächsten beiden Bildern.
 |
 |
| Bild 4: Korrodierter Eisennagel - mit und ohne Rostschicht
(Fotos: Daggi) |
Korrosionsfördernde Rolle von Neutralsalzen
Die Bildung von Ionen des Wassers und das Eisens wird durch chemisch inerte Ionen, die
Neutralsalze wie das Natriumchlorid aufbauen, gefördert. Deshalb läuft das Rosten in
Gegenwart von Salzen ganz besonders schnell ab (-> Versuch).
Das ist ganz besonders unter dem Aspekt des Streuens von Salz gegen Eisglätte
beachtenswert.
Hiervon werden nicht nur die Autokarosserien betroffen, sondern zunehmend auch die
Stahleinlagen im Beton von Brücken (Moniereisen).
Neutralsalze wirken auf zweierlei Art und Weise:
1. Sie sind Korrosions-Katalysatoren
Versuch verdeutlicht dies. Dort wird die Korrosion von
Aluminium mit Kupferchlorid beschrieben. Wenn man statt des Chlorids das Sulfat nimmt, passiert
nichts. Es ist bekannt, dass Chlorid-Ionen die Korrosion aktiv unterstützen, indem sie
helfen, das Aluminium-Gitter aufzubrechen. Sulfat-Ionen passen einfach nicht aufgrund der
Größe und sind deshalb zumindest in diesem Fall ineffektiv.
2. Sie erhöhen die aktive Konzentration der Korrosionsstoffe, hier
vor allem H+, OH- und O2 sowie CO2 und andere
Säurebildner (SO2, NOx).
Dies ist für Laien schwerer zu verstehen. Damit Ionen ihre korrosive Wirkung
ausüben können, müssen sie unbeeinflusst, also möglichst frei vorliegen.
Dies hängt u. a. von der Dielektrizitätskonstante des Wassers, von dessen
Viskosität usw. ab. Diese Werte kann man durch Neutral-Ionenzusatz so verändern,
dass sich scheinbar die Konzentration der korrosiv wirkenden Stoffe erhöht. Man spricht
hier anstatt von Konzentration von "Aktivität". Hierzu ein konkretes Beispiel:
Eine Salzsäure mit c = 0,1 mol/l sollte den pH-Wert 1 haben. Man misst mit
einem pH-Meter aber 1,5; das heißt, dass die Konzentration 10-1,5, also nur
etwa 0,032 mol/l zu sein scheint. Von der Glaselektrode des pH-Meters werden tatsächlich nur
die "aktiven" Protonen registriert. Gibt man nun Natriumchlorid zu, sinkt der pH-Wert. D. h., die
Konzentration der "aktiven" Protonen nimmt zu, die Korrosionswirkung ist stärker.
Aber auch korrosiv wirkende Gase wie CO2 oder SO2 werden in ihrer
Löslichkeit durch Neutralsalze beeinflusst. Das
erkennt man, wenn man z. B. Salzwasser zu Sprudel oder zu Sekt gibt. Aber keine
Salzkristalle zugeben; die wirken aufgrund ihrer Oberflächeneffekte.
Carbonathaltiges Wasser bremst die Korrosion von Eisen
Eisen rostet in Leitungswasser deutlich schneller als in neutralem bis schwach alkalischem
Mineralwasser (-> Versuch). In Mineralwasser sind nämlich große Mengen
an Hydrogencarbonat-Ionen enthalten, die mit den bei der Korrosion primär gebildeten Eisen(II)-Ionen
unter Bildung eines schwerlöslichen Niederschlags weiter reagieren.
Fe2+ + 2 HCO3- ———> FeCO3 + H2O + CO2
(Dieses Eisen(II)-carbonat gibt es übrigens auch als natürliches Mineral: Eisenspat oder Siderit).
Der Niederschlag entsteht an der Eisenoberfläche, schließt sie ab und verhindert den weiteren
Zutritt von Wasser, Sauerstoff oder Säureprotonen. Letztere dürfen nur in geringer Konzentration
vorliegen, denn Eisencarbonat ist nur in einem engen pH-Bereich um 7 stabil (->
Graphik 2 in Webseite). Man nennt diesen Selbstschutz von
Eisen "Passivierung". Bei längerer Einwirkung der korrosionsfördernden
Umgebung oxidiert das Eisen(II)-carbonat allerdings unter Bildung von kompliziert aufgebauten
Eisen(III)-hydroxidcarbonaten. Dann beginnt auch hier das Rosten - allerdings geht das wesentlich
langsamer als in carbonatfreiem Wasser.
Wie pH-Wert und Redoxlage das Korrosionsgeschehen beeinflussen
Diese Zusammenhänge beschreiben wir auf einer besonderen Webseite.
Korrosion und Umwelt
Korrosionsschäden treffen nicht nur das Werkstück, sondern auch die Umgebung.
Beispielsweise werden Schwermetalle wie Zink, Cadmium und Chrom, die als
Oberflächenschutz dienen sollten, mobilisiert. Aber auch Eisen(II)-Salzlösungen, die
die Sauerstoffbilanz von Gewässern stören und diese versauern, gelangen in die
Umwelt.
Korrosionsschutz
Wegen der volkswirtschaftlichen Schäden hat man eine Vielzahl von
Maßnahmen zum Korrosionsschutz entwickelt. Diese sind
kurzgefasst:
| - | Korrosion kann man präventiv durch angepasste Materialauswahl verhindern. |
| - | Korrosion betrifft in erster Linie die Metalloberflächen. Deshalb schützt man sie durch allerlei Überzüge. |
| - | Der Korrosion als Redoxphänomen kann man auch begegnen, indem man die Abgabe von Eisen-Ionen oder von Elektronen verhindert. |
Weitere Texte zum Thema „Auto“