 |
| Bild 1 (Foto: Blume) |
Korrosionsschutzmaßnahmen
Experimente:
Versuch: Spezialstahl rostet weniger oder gar nicht
Versuch: Wann eine verzinnte Dose korrodiert
Versuch: Entfernung von Rost
Versuch: Rostet Eisen mit Metallüberzügen?
Versuch: Galvanische Überzüge
Versuch: Lackieren und Rostschutz
Versuch: Eloxieren
Versuch: Kathodischer Korrosionsschutz
Versuch: Opferanode
Wegen der volkswirtschaftlichen Schäden durch die Korrosion
hat man eine Vielzahl von Maßnahmen zum Korrosionsschutz entwickelt. Allerdings reicht es nicht
aus, das zu schützende Metall mit einer Plane abzudecken, wie es momentan in Ostwestfalen am
Hermannsdenkmal ausprobiert wird (siehe folgendes Bild). Wie man sieht, hat man dem Hermann schlicht
ein blaues Fußballertrikot übergezogen.
 |
| Bild 1 (Foto: Blume) |
Die wirklich wirksamen Korrosionsschutzmaßnahmen sind kurzgefasst:
| - | Korrosion kann man präventiv durch angepasste Materialauswahl verhindern. |
| - | Korrosion betrifft in erster Linie die Metalloberflächen. Deshalb schützt man sie durch allerlei Überzüge. |
| - | Der Korrosion als Redoxphänomen kann man auch begegnen, indem man die Abgabe von Eisen-Ionen oder von Elektronen verhindert. |
Angepasste Materialauswahl und Konstruktion
Bevor man auf toxische Überzüge zurückgreift, kann man auch präventiv vorgehen.
Beispiele sind Spezialstähle (-> Versuch).
Aber auch Aluminium/Mg-Legierungen sind zu nennen, die für den
Fahrzeug- und Flugzeugbau zunehmend wichtiger werden. Beide
Metalle sind extrem unedel, überziehen sich aber mit einem dünnen Film von inertem Oxid
(Passivierung).
Gleiches gilt für Titan. In diesem Zusammenhang ist
auch Chrom zu nennen, das Eisen in neutraler Umgebung wegen der
Bildung von inertem Chrom(III)-oxid schützt.
Des Weiteren muss durch Planung bei der Konstruktion auf mögliche Kontakte von
Metallen geachtet werden, die korrosionsfördernde Lokalelemente bilden können.
Oberflächenveränderung durch metallische Überzüge
Besonders wichtig ist der Schutz durch metallische Überzüge, wobei Schwermetalle
wie Sn, Cr, Cu, Ni, Mn, Zn und Cd eingesetzt werden. Dabei wirken Cr, Sn und Ni
besonders aufgrund ihrer Passivierung, während Zn daneben auch als Opferanode
(siehe auch im Text weiter unten) dient. Deshalb gibt der Autohersteller auf verzinkte
Karossen nur eine begrenzte Garantie.
Auftragetechniken sind Galvanisieren, Plattieren, Aufdampfen, Feuerverzinken.
Galvanisieren ist die elektrolytische Abscheidung von metallischen Überzügen auf Gegenständen aus unterschiedlichen Werkstoffen, vorwiegend Metallen oder auf mit Graphit elektrisch leitend gemachten Nichtleitern (Kunststoffe). Dabei erhält man Verbundwerkstoffe mit Oberflächeneigenschaften, die das Grundmaterial überhaupt nicht oder zumindest nicht in dieser Güte aufweist. Wichtige Metalle, die galvanisch abgeschieden werden, sind Kupfer, Nickel, Zink, Cadmium, Chrom, Zinn, Silber und Gold (-> Versuch).

Bild 2: Vernickeltes Eisen erkennt man an den gelblichen Anlauffarben
(Foto: Daggi)
Plattieren, der weitaus bedeutendste
Prozess zum Korrosionsschutz, ist der direkte Auftrag einer Metallschicht auf ein
Werkstück (z. B. durch Walzen, Sprengung etc...). Hier ist auch an das Auftragen von
Blattgold zu erinnern.
Aufdampfen von Metallen erfolgt im Vakuum.
Feuerverzinken: Man taucht das Werkstück in flüssiges Zinkmetall (-> Versuch). Ähnlich geht man beim Verzinnen zur Herstellung von Weißblech vor.
Oberflächenveränderung durch nichtmetallische Überzüge
Überzüge sollen Wasser und Sauerstoff abhalten, sind also häufig
Lacke, die mit oder ohne Lösemittel aufgetragen werden
(-> Versuch). Weitere Beispiele sind
Aufschlämmungen von Pigmenten wie Mennige Pb3O4 oder anderen
oxidierenden Schwermetalloxiden.
Bekannt sind auch künstliche Oxidüberzüge. Hierzu elektrolysiert man
Aluminium in Oxalsäurelösungen und verstärkt dessen Passivierung
(anodische Passivierung, Eloxieren;
-> Versuch).
Kathodischer Korrosionsschutz
Das zu schützende Werkstück wird an den negativen Pol einer Gleichstromquelle
angeschlossen (-> Versuch).
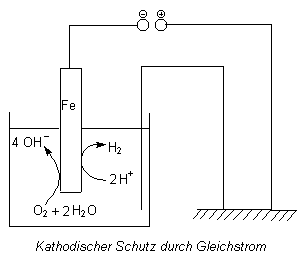
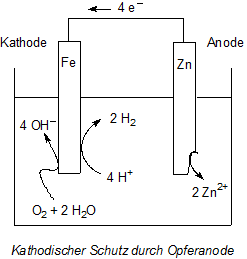
Man kann es aber auch durch bewusst korrodierenden Kontakt mit einem unedleren Metall (wie Mg) kathodisch schalten (-> Versuch Opferanode). Damit wird das Werkstück negativ aufgeladen und so die Abgabe von Eisen-Ionen verhindert und die Rostbildung unterbunden. Da hierbei das andere Metall oxidiert wird, bezeichnet man dieses als Opferanode. Dieses Verfahren spielt beim Rostschutz von Schiffen, aber auch von Heizungsanlagen eine wichtige Rolle. Viele Hausheizungen verfügen über Opferanoden, ohne dass die Besitzer dies wissen und so die Erneuerung versäumen.
Anforderungen an die Überzüge
Beim Auto wird deutlich, was die Überzüge zu leisten haben. Sie müssen stabil sein
gegen:
| - | mechanische Beanspruchungen (Kratzer, Schwingungen), |
| - | Lösemittel wie Benzin und Öl, |
| - | chemische Beanspruchungen, vor allem gegenüber elektrolythaltiger Feuchtigkeit (Salzwasser, saurer Regen), |
| - | UV-Strahlung, |
| - | extreme Temperaturwechsel. |
Was ist, wenn der schützende Überzug verletzt wird?
Wird bei edleren Eisenschutzmetallen wie z. B. Zinn oder Chrom der Überzug verletzt,
beginnt die Korrosion des Eisens erst recht, da sich Lokalelemente bilden, bei denen
Eisen die Rolle der Opferanode übernimmt. (Ausblühen von Weißblech
(-> Versuch), von verchromten Stoßstangen.) Mit dem
abblätternden Rost gelangen die eigentlich schützen sollenden Schwermetalle in die
Umwelt.
Was tun gegen Rost?
Und wenn der Rost erst einmal angefangen hat, muss man ihm rasch zuleibe rücken.
Bevor man erneut einen Überzug aufträgt, muss der Rost entfernt werden. Das machen
spezielle Chemikalien, die Rostentferner oder
Rostumwandler (-> Versuch).
Beide wirken prinzipiell ähnlich. Die ersteren (z. B. Citronensäure) lösen den Rost ab
und hinterlassen mehr oder weniger blankes Eisen. Das wirkt allerdings aufgrund des
Kohlenstoffgehalts dunkelmatt.
Dagegen wandeln Rostumwandler unter Mitwirkung von Netzmitteln (Tensiden) Rost z. B. in
stärker haftendes Eisenphosphat um - mit aufschiebender Wirkung.
Weitere Texte zum Thema „Auto“