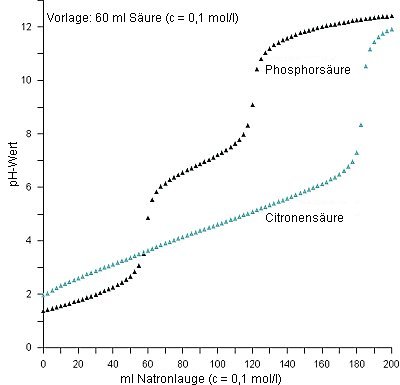
 |
| Titrationskurven von Phosphorsäure
und Citronensäure (Messung: Daggi) |
Die Titrationskurve der Citronensäure
Experiment:
Versuch: Aufnahme der Titrationskurve von Citronensäure
Bei der Aufnahme von Titrationskurven verfolgt man den pH-Wert als Funktion der
Zugabe von Natronlauge.
Man beobachtet, dass der pH-Wert nicht gleichmäßig steigt, sondern am
Äquivalenzpunkt einen großen Sprung macht und sich davor und dahinter nur sehr
langsam ändert. Das liegt daran, dass sich vor und hinter dem Äquivalenzpunkt
Puffersysteme bilden, die den pH-Wert über Gleichgewichtsreaktionen stabilisieren.
Am Äquivalenzpunkt liegt eine reine Salzlösung vor, das Gleichgewicht ist also
ausgereizt. Titriert man eine starke Säure (wie HCl), so liegen daneben die Puffersysteme des Wassers:
unter pH 7: H3O+/H2O und oberhalb pH 7: H2O/OH-.
Bei schwachen einbasigen Säuren wie der Essigsäure liegt ein zusätzliches
Puffersystem vor dem Äquivalenzpunkt, hier bei pH 8: HAc/Ac-. Der Wendepunkt bei
Halbäquivalenz ist der pKS-Wert der Säure; er liegt im Fall der Essigsäure bei pH
4,75.
Zweibasige Säuren zeigen zwei Äquivalenzpunkte und zwei pKS-Werte,
wenn (wie bei den Aminosäuren) die pKS-Werte weit getrennt im mittleren pH-Bereich liegen.
Bei dreibasigen Säuren sollten drei Äquivalenzpunkte und drei pKS-Werte
zu sehen sein. Die Phosphorsäure zeigt aber nur jeweils zwei (-> Bild). Das liegt daran,
dass sich das dritte Gleichgewicht bei pH 12,3 mit dem zweiten Wasser-Puffersystem
H2O/OH- überschneidet.
Da auch die Citronensäure eine dreiprotonige Säure ist und die pKS-Werte
im mittleren pH-Bereich liegen, müssten doch, wenn man sie titriert, drei Äquivalenzpunkte
und pKS-Werte als pH-Wert-Sprünge bzw. als Wendepunkte sichtbar werden.
Es gibt ja schließlich auch drei Reihen von Salzen: Dihydrogencitrate, Hydrogencitrate
und Citrate. Wenn du dir aber die Titrationskurve einer Citronensäuretitration (->
Versuch) anschaust, wirst du feststellen, dass nur ein pH-Sprung
zu sehen ist, nämlich der, wenn die Säure vollständig neutralisiert ist (-> Bild).
Der Grund ist, dass die drei Dissoziationsgleichgewichts-Systeme bei der
Citronensäure sehr dicht beieinander liegen. Die pKS-Werte sind:
pKS1 = 3,13 pKS2 = 4,76 pKS3 = 6,40
Damit vereinigt die Citronensäure hinsichtlich ihrer Stärke in sich nacheinander näherungsweise drei Säuren: Ameisensäure (pKs = 3,77), Essigsäure (pKs = 4,75) und Kohlensäure (pKs = 6,35).
Aufgrund dessen liegen bei der Titration von Citronensäure das Dihydrogenanion und das Hydrogenanion nicht rein vor. (Bei der analogen Phosphorsäure ist das der Fall.) Die Lösung enthält über weite Bereiche der Titration sowohl freie Citronensäure als auch alle drei Anionentypen. Dadurch entsteht ein kompliziertes, dicht überlappendes Puffersystem, das aus drei Gleichgewichten zusammengesetzt ist:
CitH3 / CitH2- CitH2- / CitH2- CitH2- / Cit3-
Aus diesem Grund ist die Citronensäure mit ihren Anionen ein sehr effektives und technisch gern genutztes Puffersystem. Erst am Äquivalenzpunkt der dritten Dissoziationsstufe, wenn in der Lösung nur noch das tertiäre Salz vorliegt und damit der Puffer verbraucht ist, ist bei weiterer Zugabe von Natronlauge eine plötzliche und recht starke Änderung des pH-Wertes zu erkennen.
 |
| Titrationskurven von Phosphorsäure
und Citronensäure (Messung: Daggi) |
Warum stimmt der Äquivalenzpunkt der Citronensäure meistens nicht?
Citronensäure bildet als Monohydrat Kristalle mit Hydratwasser.
Solche Kristalle verwittern, d. h. sie geben ihr Kristallwasser an die Außenluft ab. Das hat zur
Folge, dass es oftmals schwer ist, exakt konzentrierte ("eingestellte") Lösungen dieser
Säure herzustellen. Beim Titrieren einer auch noch so genau wie möglich
abgewogenen Portion dieser Säure beobachtet man fast immer, dass bis zum
Äquivalenzpunkt mehr Natronlauge zugegeben werden muss, als zuvor berechnet
wurde. Grund: Da die Säure beim längeren Stehen in der Sammlung Hydratwasser
verloren hat, also verwittert ist, wiegt man einfach zuviel Citronensäure ein.
Der Verbrauch an Natronlauge ist deshalb zu hoch.
Vorteil: Umgekehrt kann man durch Titration natürlich auch den Verwitterungsgrad der
Citronensäure ermitteln.
Wenn man eine genaue Titrationskurve der Citronensäure aufnehmen will, so sollte man eine 0,1-molare
Lösung von Tri-Natriumcitrat herstellen. Das Lösemittel ist 0,3-molare Salzsäure. Da das Natriumcitrat
haltbarer als Citronensäurehydrat und somit besser abzuwiegen ist, hat man sich dadurch eine exakte
Lösung von Citronensäure hergestellt.
Lesen Sie dazu unseren Tipp des Monats.
Weitere Texte zum Thema „Zitrone“