Die Energieumwandlungen bei umkehrbaren Reaktionen
Experimente:
Versuch: Synthese und Analyse von Silbersulfid
Versuch: Das reversible Zink/Iod-Element
Es gibt für die Schulchemie nur wenige wirklich umkehrbare Reaktionen, an denen
man auch das Prinzip der reversiblen Energieumwandlung zeigen kann. Eine davon
ist die Reaktion zwischen Silber und Schwefel unter Bildung von Silbersulfid. Das
andere Beispiel gehört in die Elektrochemie: es handelt sich um den Zink/Iod-Akkumulator.
Die Silber/Schwefel-Reaktion
Die Sulfidbildung aus Metallen und Schwefel ist als Oxidation grundsätzlich mit
Energiefreisetzung verbunden. Das wird anhand anderer Metalle wie Zink, Eisen oder
Kupfer deutlicher als beim Silbersulfid (-> Webseite). Das kann man in
Vorversuchen zeigen. Jedoch ist leider nur die Silbersulfidbildung reversibel.
Erhitzt man also Silber und Schwefel, so bildet sich Silbersulfid (->
Versuch).
2 Ag + S ———> Ag2S + Energie
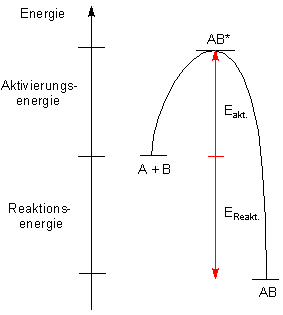
Solche Reaktionen sind exotherm. Wir sprechen bei dieser Form von
Reaktionsenergie auch von Wärmetönung.
Im Allgemeinen sind jedoch alle Reaktionen gehemmt. Man muss deshalb alle
Reaktionen erst einmal aktivieren. Das ist wie bei einem Stein, den wir einen
Abhang hinunterrollen wollen: Zunächst müssen wir ihn "lostreten". Auch wenn wir
mit einem Fahrrad den Berg herunterrollen wollen, müssen wir uns erst abstoßen.
Der Vergleich ist gar nicht so schlecht. Wir sprechen vom Aktivieren einer Reaktion,
die zugeführte Energie ist die Aktivierungsenergie.
Das ist nicht immer leicht zu erkennen: Beim Silber müssen wir ständig aktivieren,
damit sich genügend Silbersulfid bilden konnte. Solch ein langanhaltendes
Aktivieren kann man leicht mit Zufuhr an Reaktionsenergie verwechseln.
Man zeichnet hierzu ein Energieschema:

Energieschema einer exothermen Reaktion
Die Umkehrung der Bildungsreaktion von Silbersulfid aus den Elementen gelingt
leicht (-> Versuch).
Ag2S + Energie ———> 2 Ag + S
Wir haben hier eine endotherme Reaktion. Das entspricht den Anstrengungen, einen Stein den Abhang hinaufrollen oder mit dem Fahrrad bergauf zu fahren.
Eine endotherme Reaktion muss aber auch aktiviert werden. Um bei unserem Modell zu bleiben: Auch bergauf muss man den Stein erst einmal ins Rollen bringen. Und man muss auch einmal kräftig antreten, wenn man mit dem Fahrrad bergauf fahren will. Dann geht es zwar langsam weiter - aber es geht.... In der Chemie erkennen wir einen endothermen Verlauf wie bei unserem Versuch zur Zersetzung von Silbersulfid daran, dass sich trotz Erhitzens zu Beginn erst gar nichts tut, dann aber plötzlich der Schwefel in großen Mengen freigesetzt wird. Auch eine endotherme Reaktion muss also erst "anspringen".
Bei endothermen Reaktionen ist die Aktivierungsenergie besonders hoch. Das können wir wieder auf unser Modell übertragen. Es kostet besonders große Anstrengungen, einen Stein gegen den Berg überhaupt erst einmal ins Rollen zu bringen. Oder man steht mit dem Fahrrad am Berg, den man hinauffahren will. Dann bedeutet das "Lostreten" erfahrungsgemäß eine besonders große Anstrengung. Entsprechend sieht auch das Energieschema aus.
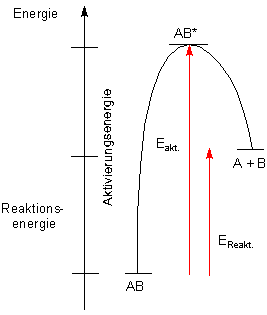
Energieschema einer endothermen Reaktion
Wir können beide Diagramme natürlich in ein Bild zeichnen.
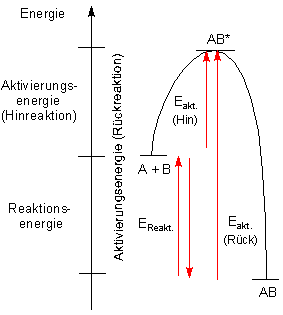
Energieschema einer umkehrbaren Reaktion
Das Zink/Iod-Element
Das Zink/Iod-Element (-> Versuch) ist ein Akkumulator, der wieder
aufgeladen werden kann. Im geladenen Zustand läuft folgende energieliefernde
Entladungsreaktion ab:
Zn + I2 ———> ZnI2 + Energie
Die Reaktionsenergie ist hier die elektrische Energie. Die Reaktion ist exotherm.
Wir sprechen bei exothermen elektrochemischen Reaktionssystemen von
einem galvanischen Element.
Auch hier müssen wir aktivieren. Das merken wir nicht so direkt wie bei der
Herstellung von Silbersulfid, weil sich das galvanische Element seine Energie selbst
aus dem System herausholt. Wir bekommen einfach nur weniger Energie, als wir
erwarten.
Zur Umkehrung der Reaktion müssen wir aufladen. Dabei führen wir elektrische Energie zu. Die Reaktion ist also endotherm.
ZnI2 + Energie ———> Zn + I2
Elektrochemische endotherme Reaktionen sind die Elektrolysen.
Auch hier müssen wir aktivieren. Das merken wir daran, dass wir eine höhere Spannung anlegen müssen, als wir nach den Tabellen erwarten oder als wir aus dem umgekehrten galvanischen Element herausbekommen. Wir nennen die Aktivierungsenergie nicht ganz exakt Überspannung.
Weitere Texte zum Thema „Energie und Chemie“