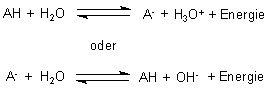
Das klassische Acetat-Puffersystem
Experimente
Versuch: Titration eines Gemisches aus Salzsäure und Essigsäure
Versuch: Abhängigkeit der Pufferwirkung von der Konzentration
des Säure/Base-Systems
Die Pufferung spielt in der Chemie eine große Rolle. Ohne sie wären Bodenchemie oder Biochemie
nicht denkbar. Ohne den Klassiker der Puffersysteme, den Acetat-Puffer bei pH 4,75, hätten auch
Michaelis und Menten nicht ihre bahnbrechenden Arbeiten zur Enzymkinetik
entwickeln können.
Das Gleichgewicht eines schwachen Säure/Base-Systems ist erstaunlich unempfindlich gegen pH-Wert-Änderungen.

Das gilt ganz besonders für Mischungen von Säuren und ihren korrespondierenden Basen.
Gibt man z. B. zu einer Mischung von Essigsäure und Acetat eine starke Säure (HCl), so verschiebt sich
das o. a. Gleichgewicht ohne sonderliche pH-Wertänderung nach links. Gibt man eine Lauge (NaOH) zu, so
verschiebt sich das Gleichgewicht ohne sonderliche pH-Wertänderung nach rechts.
Das erkennt man beim Betrachten von Titrationskurven. Die Kurve der Salzsäure steigt im mittleren pH-Bereich stark an; die der schwachen Säure-Base-Systeme kaum. Beim Wendepunkt WP2 ist die pH-Wertänderung am geringsten. Hier ist die Konzentration von Säure gleich der ihrer korrespondierenden Base: pH = pKs. Dies ist der Punkt der besten Pufferung.
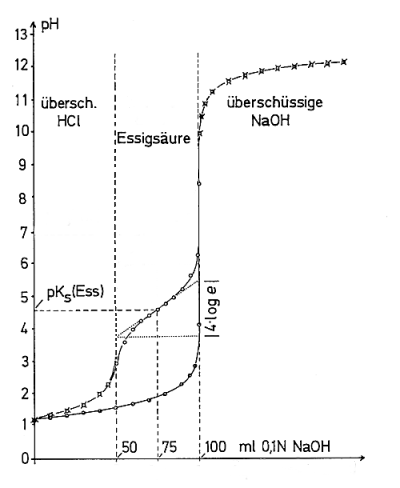
Bild 1: Titrationskurven von Salzsäure und einem Gemisch aus Salzsäure und Essigsäure
(-> Versuch)
Das Bild zeigt neben der Titrationskurve der starken, also nichtpuffernden Salzsäure das Puffersystem Essigsäure/Acetat.
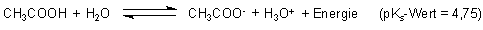
Die Steigung a der Wendetangente an die Titrationskurve in pH = pKs ist
a = pH-Wertänderung / ml Natronlauge
Je konzentrierter das Puffersystem ist, desto schwächer ist die Steigung, desto höher ist die Pufferwirkung. Das zeigt das folgende Bild.
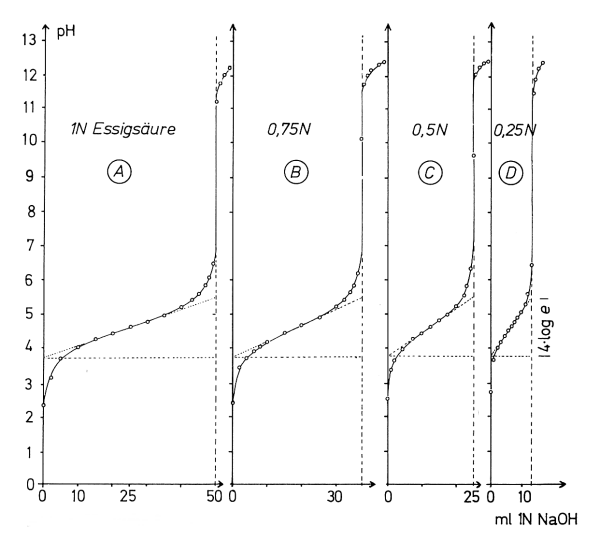
Bild 2: Titrationskurven von Essigsäure verschiedener Konzentrationen mit Natronlauge (c = 1 mol/l).
Bedingungen siehe Versuch
Deshalb bezeichnet man den Kehrwert der Steigung als Pufferkapazität b. Sie ist proportional zur Konzentration des puffernden schwachen Säure/Base-Systems.
b = ml Titriermittel / pH-Einheit
Sie ist proportional zur Konzentration des puffernden schwachen Säure/Base-Systems. Damit sich der pH-Wert während einer Kinetik nicht merklich ändert, sollte der Puffer etwa 1000mal konzentrierter sein als die erwartete Säure- oder Basefreisetzung.
Genauere Hintergründe zur Theorie der Pufferung findet man in dieser Webseite.
Weitere Texte zum Thema „Essig“