Essig ist nicht Essigsäure! |
Essig enthält eine Säure
Experimente:
Versuch: Essig enthält eine Säure
Versuch: Protolyse von Natriumacetat

Essig ist nicht Essigsäure! |
Erst die Säure macht den Essig so beliebt
Essig wird gern genommen, weil er so schön sauer schmeckt. Man nutzt ihn als Appetitanreger, aber
auch als Konservierungsstoff für empfindliche Lebensmittel ("sauer einlegen") oder auch als Entkalker.
Allerdings greift er auch Metall an, wie die Verchromungsschicht der Armaturen im Bad.
Der Grund für alles ist: Essig enthält eine Säure, die Essigsäure.
Säuren haben bestimmte Eigenschaften
Diese Eigenschaften kann man mit einigen kleinen Versuchen erkunden (-> Versuch).
| - | Säuren färben Indikatoren entsprechend, z. B. den Rotkohlsaft rot. |
| - | Säuren reagieren mit unedlen Metallen wie Magnesium unter Freisetzung von Wasserstoff. |
2 CH3-COOH + Mg ———> 2 CH3-COO- + Mg2+ + H2
| - | Säuren zersetzen Kalkstein unter Entwicklung von CO2. |
2 CH3-COOH + CaCO3 ———> 2 CH3-COO- + Ca2+ + H2O + CO2
Säuren sind Protonen-Donatoren
Bei der Essigsäure, die ja vier Wasserstoffatome gebunden trägt, übernimmt die Hydroxylgruppe der
Carboxylgruppe diesen Part: Sie kann ein Proton abgeben.
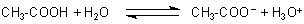
Dies ist eine Gleichgewichtsreaktion mit deutlicher Lage auf der linken Seite, da nicht alle Carboxylgruppen ihre Protonen entlassen. Die Dissoziation einer einmolaren Essigsäure beträgt in Wasser etwa nur ein Promille. Aus diesem Grunde ist die Leitfähigkeit einer einmolaren Essigsäure viel geringer als die der vollständig dissoziierten Salzsäure.
Anionen schwacher Säuren sind Protonen-Akzeptoren
Die geringe Neigung zur Dissoziation zeigt sich auch am folgenden Effekt: Wenn man Natrium-Acetat, das
Natrium-Salz der Essigsäure in Wasser löst, holen sich die Acetat-Anionen ihre Protonen zurück. Die spalten
sie von den Wassermolekülen ab, wodurch die Lösung alkalisch reagiert (-> Versuch).
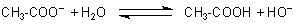
Die Acetat-Ionen sind also Protonen-Akzeptoren. Man nennt solche Stoffe Basen.
Warum die Essigsäure überhaupt sauer ist, erklären wir hier.
Weitere Texte zum Thema „Essig“