 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
951
F: Eine kleine Frage beschäftigt mich jetzt schon seit
längerer Zeit: Wenn man konzentrierte Salzsäure in einer Petrischale hat fängt diese an zu rauchen
weil durch eine Übersättigung Chlorwasserstoffgas entweicht. Nun zu meiner Frage: Warum raucht
die Salzsäure stärker wenn man in einem kleinen Abstand daneben, konzentriertes Ammoniakwasser
tropft? Ich hoffe sie finden Zeit mich seiner Frage anzunehmen, für eine antwort danke ich
schon mal im Voraus.
A: Salzsäure und Ammoniakwasser sind wässerige Lösungen
von Gasen: HCl (Chlorwasserstoff) und NH3 (Ammoniak). Die beiden Gase reagieren zusammen
zu einem weißen Festkörper, Ammoniumchlorid NH4Cl.
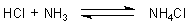
Deshalb raucht es. Schauen Sie in unsere Webseiten zum Chemischen Gleichgewicht.
952
F: Ich habe im Internet Ihren Artikel "Wir untersuchen Lakritz"
gelesen. Sie führen dort auch Versuche mit Ammoniumchlorid durch. Nun wollte ich fragen ob
Ammoniumchlorid auch als Droge verwendet wird. Neulich habe ich bei einem Freund, der kein
Chemiker ist, ein Fläschchen gesehen, das weißes Pulver einthielt und mit Ammoniumchlorid
beschriftet war. Da ich weiß, dass er es schon einmal mit Drogen zu tun hatte, mache ich mir
nun Sorgen, ob er wieder rückfällig geworden ist. Ich selbst besuche die 12. Klasse eines
Gymnasiums in Bayern und werde nächstes Jahr mein Abitur in den Fächern Biologie und
Französisch schreiben.
Ich würde mich freuen, wenn Sie mir weiterhelfen!
A: Ammoniumchlorid ist zwar wegen der Ammonium-Ionen
physiologisch wirksam. Aber als Rauschmittel würde ich es nicht einstufen. Man bekommt vielleicht
Hitzezustände, wenn man zuviel davon isst.
Sprechen Sie Ihren Freund trotzdem darauf an. Vielleicht tarnt er nur sein Rauschgift. Denn viele
denken, dass die Chemiker nur nach Stickstoffverbindungen suchen und deshalb steht Ammoniumchlorid
für (normalerweise N-haltiges) Rauschgift. (Ausnahme: Cannabis.)
953
F: Ich habe vor einigen Wochen mein Chemie- und Biologiestudium
begonnen. In Chemie hatte ich das Glück in viele praktische Kurse zu kommen. Diese sind mit dem
eigenständigen Erarbeiten von Versuchen verbunden. Da ich bisher erfolglos einen Versuch zu dem
Thema "Qualitativer Nachweis von Alkalimetallionen und NH4+" gesucht habe wende ich mich nun mit
der Bitte, um Hinweise oder ähnliches, an sie.
A: Man kann Alkalimetall-Ionen spektroskopisch nachweisen -
meinetwegen auch anhand der Flammenfärbung. Das geht vor allem gut beim Na.
K weist man daneben auch als KClO4 nach, Ammonium durch Zugabe von Natronlauge oder festem
NaOH zu der Probe - es entweicht Ammoniak.
Haben Sie denn gar keine Literaturempfehlung - z. B. für den Jander-Jahr-Blasius - bekommen?
Was ist das für eine Uni!
Fragen Sie doch einmal Ihre Dozenten oder auch Ihre Assistenten!
954
F: Wenn man Wasser in Anis-Schnaps gibt, wird er milchig. Was passiert da?
A: Hintergrund eines Anisschnapses ist ein alkoholischer
Auszug von Terpenen aus der Anispflanze, der mit Wasser etwas verdünnt worden ist. Die unpolaren
Terpene ("Terpentin") sind in Wasser kaum löslich, wohl aber in reinem Ethanol und auch in
Ethanol-Wasser-Gemischen. Das gilt aber nur bis zu einer bestimmten Wassergehaltsgrenze. Gibt
man noch mehr Wasser hinzu, bildet sich eine so genannte "Mischungslücke"; die Terpene sind nicht
mehr löslich und "fallen aus". Das heißt, eine zweite Phase bildet sich aus und eine Emulsion entsteht.
955
F: In einer Chemieklausur wurde nach der Brausewirkung einer
Aspirin plus C-Tablette gefragt. Allerdings wurde diese Aufgabe (vielleicht weil es nur eine
Nebenaufagbe war) nie wirklich besprochen. Die einzige Andeutung war das Ascorbinsäure mit
Natriumcarbonat (unter Abgabe von Kohlendioxid) eine Reaktion eingeht . Könnten sie mir die
genauen Reaktionen erklären ? Ich hoffe auf baldige Antwort.
A: Ascorbinsäure bildet mit Soda oder Natron
Kohlensäure, die beim Zerfallen CO2 freisetzt. Sie könnten auch Essig- oder
Citronensäure nehmen.