 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1561
F1: Unsere Hausaufgabe ist es den Namen des Stoffes zu finden, der sich hinter
folgender Formel verbirgt:
[(NH2)CO(NH3)]+
Ich wäre Ihnen sehr dankbar, wenn sie mir den Namen nennen könnten.
A1: Es soll sich offensichtlich um Harnstoff handeln,
der im sauren Milieu nach Meinung des Aufgabenstellers protoniert vorliegen soll.
Hier ist zunächst einmal die Strukturformel von Harnstoff:
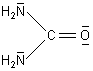
So ganz richtig ist die von Ihnen angegebene Formel [(NH2)CO(NH3)]+ nicht, denn die Aminogruppen in diesem Kohlensäure-di-amid reagieren nicht basisch. Grund: Deren freies Elektronenpaar, auf dem ja die Basizität beruht, ist zum zentralen C-Atom hingezogen. Ursache ist der starke Elektronenzug des besonders elektronegativen Sauerstoffatoms. Dieser Effekt wird durch Protonierung des Sauerstoffs noch verstärkt. Deshalb sieht Harnstoff im Sauren so aus:
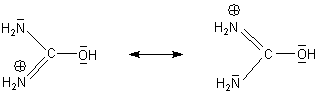
Wir sehen, dass es mesomere Grenzstrukturen gibt.
Mehr zu den Säureamiden finden Sie hier.
F2: Auf meine Frage, wie dieses Ion: [(NH2)CO(NH3)]+ heißt, haben Sie mir bereits geschrieben,
dass es sich um Harnstoff handelt, der protoniert vorliegt. Leider gibt sich meine Chemielehrerin damit nicht zufrieden, denn sie möchte
den systematischen Namen dieses Ions wissen.
Ich wäre ihnen sehr verbunden wenn sie mir dabei weiterhelfen könnten.
A2: Sagen Sie Ihrer Lehrerin, dass es dieses Ion nicht gibt. Wenn sie anderer Meinung ist,
soll sie mit mir Kontakt aufnehmen. Vor allem soll sie den Text lesen, den ich Ihnen geschickt habe.
Aber wenn Ihre Lehrerin darauf besteht, können Sie ja Harnstoffium-Ion oder Ureahydroxylium-Ion oder Ähnliches vorschlagen…
Sie ist wahrscheinlich eine Seiteneinsteigerin und hat auf diesem Ion herumgeforscht…
1562
F: Wir haben folgenden Versuch durchgeführt: ein Zinkblech wurde in eine 0,1 molare Kupfersulfatlösung
getaucht. Es wurde eine Fällung sichtbar, die jedoch schwarz und nicht wie erwartet rotbraun aussah. Dennoch muss es sich dabei um Kupfer
handeln, aber weshalb sieht die Schicht schwarz aus?
A: Sehr fein verteiltes Metall ist immer schwarz. Denken Sie an Silber: Damit macht man bekanntlich
Schwarz-Weiß-Fotos.
Wenn Sie richtig braunrotes Kupfer sehen wollen, müssen Sie den Ansatz ein paar Tage stehenlassen! Dann bilden sich größere Kristalle, die dann Licht mit der typischen Farbe reflektieren.
Machen Sie den Versuch auch mal mit Silbernitratlösung. Zuerst ist der Silberniederschlag schwarz, dann grau. Spätestens nach einer Stunde sieht man das herrliche Glitzern und Blinken der langen Silberkristalle.
1563
F: Gestern Abend war Frageabend bei Günter Jauch. Wir lernten, dass der Harzer Roller kein Käse,
sondern ein Kanarienvogel sei. Dabei wurde der Harzer Roller als etwas aufgeführt, das zum Bergbau gehört. Bei der Auflösung meinte der
Moderator, es sei nur ein Freizeit-Hobby der Bergleute gewesen, sich mit den Kanarienvögeln zu beschäftigen. Was steckt wirklich dahinter?
A: Es steckt wahrscheinlich mehr dahinter, dass gerade Bergleute sich mit diesem Hobby befassten.
Kanarienvögel waren eine Art Sensor für Luftverschmutzung. Die Männchen singen sich merkwürdigerweise auch unter Tage an. Wenn die Vögel
aufhörten zu singen, „lag etwas in der Luft“ – zum Beispiel ein „Schlagendes Wetter“, also Methan. Der Begriff „schlagend“ steht für
explosiv und „Wetter“ für Luft.
Manche Leute meinen, an dieser Story sei nichts dran. (Schön ist sie trotzdem…) Die Bergleute hätten statt ihrer wertvollen „Kanaris“ lieber in Fallen oder Netzen gefangene Wildvögel als Biosensoren eingesetzt.
Was ist der wissenschaftliche Hintergrund für diese Nutzung? Kleine Vögel verfügen über eine extrem hohe Stoffwechselrate; sie sind deshalb besonders empfindlich gegen Sauerstoffmangel und Luftverschmutzung.
Woher stammt eigentlich der Name „Roller“? Es sieht so aus, dass dahinter eine Lautäußerung des Vogels steckt, die wie ein „rollendes r“ klingt. Kanarienvögel sollen in diese Richtung gezüchtet worden sein. Roller hat aber auch etwas mit Geröll zu tun – da denkt man wieder an den Bergmann. Gezüchtet wurde vor allem in Gebieten, wo Bergbau vorherrscht - also auch im Harz. Der Ort Sankt Andreasberg ist deshalb eine Hochburg der Kanarienzucht.
Übrigens ist der „Harzer Roller“ tatsächlich auch ein fettarmer Handkäse auf Sauermilchbasis. Hier ist dazu ein Fotodokument:

(Foto: Blume)
1564
F: Ich moechte gerne wissen in wiefern Wasserstoffbindungen die Verdampfung von Primaeren
Alkoholen beeinflusst wobei mich Methanol, Ethanol, Propanol, Butanol und Pentanol am meisten interessieren. Oder liegt die
Verdampfungsgeschwindigkeit hauptsaechlich an der groesse des Molekuels?
A: Bei solchen Fragen wäre es gut, wenn Sie angeben würden, auf welchem Level Sie
eine Antwort erhalten wollen... Vor allem geht es auch um Vorkenntnisse. Eine kleine persönliche Vorstellung wäre also nicht schlecht.
Hier ist die Liste der primären Alkohole (n-Alkohole):
| n-Alkohol | Zahl der C-Atome | Siedepunkt (1,013 bar, °C) |
| Methanol
Ethanol Propanol Butanol Pentanol Hexanol Octylalkohol Decylalkohol Laurylalkohol |
1
2 3 4 5 7 8 10 12 |
64,7
78,3 97,2 117,7 138,0 155,8 194,0 232,9 259,0 |
(Längerkettige Alkohole sieden bei Normaldruck nur unter Zersetzung.)
Die Moleküle der Alkohole hängen vor allem über Wasserstoffbrücken zwischen den beiden Hydroxylgruppen zusammen, auch im Dampf. Daher rührt der im Vergleich zu den entsprechenden Kohlenwasserstoffen hohe Siedepunkt.
Definieren wir „Molekülgröße“ einmal über die Masse. Sie sehen zwar, dass die Siedetemperatur mit der Molmasse ansteigt, dass es aber keine einfache Proportionalität zwischen Molmasse und Siedepunkt gibt. Die Größe des Moleküls spielt aber insofern eine Rolle, als es einen weiteren Bindungstyp zwischen den Alkoholmolekülen gibt, die sich mit zunehmender C-Kettenlänge mehr und mehr bemerkbar macht, die van der Waals-Bindung.
1565
F: Wie macht man Streichhölzer sicher gegen Nachglimmen?
A: Man macht Holz weniger nachglimmfähig, indem man es mit Ammonium(hydrogen)phosphat
behandelt. Diese Substanz können Sie in Streichhölzern nachweisen. Seine Funktion: Beim Erhitzen wird die Substanz zersetzt,
indem sie Ammoniak und Wasserdampf abgibt.
4 NH4H2PO4 + Energie ———> 4 NH3 + 6 H2O + P4O10
Dieser Prozess ist endotherm und kühlt die Glut ab.
Es gibt noch mehr Verbindungen, die ähnlich wirken. Zur Zeit des Zweiten Weltkriegs mussten die Dachbalken mit Aufschlämmung von gebranntem Kalk geweißt werden. Im gealterten Anstrich sind ebenfalls Verbindungen enthalten, die sich in der Hitze zersetzen, z. B. Calciumhydroxid, Calciumhydrogencarbonat und Calciumcarbonat. Außerdem sollte das alkalische Milieu mit Phosphor reagieren und so sein Brennen unterbinden. Denn dessen Einsatz befürchtete man schon während der Planung des Kriegs.