 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1556
F: Betreff: Versuch mit Wasserglas
Hallo Herr Prof. Blume,
ich kann mich grob an einen Versuch im Chemie-Unterricht erinnern, bei dem Salze in Wasserglas gegeben wunderschöne Strukturen,
wie kleine Bäumchen, ergaben. Dieses Experiment würde ich gerne zusammen mit meiner Tochter durchführen, nur leider kann ich nichts
dazu finden, welche Substanzen in das Wasserglas gegeben werden sollen und wie die anderen Versuchsbedingungen sind, wie z.B. Temperatur.
Ich würde mich sehr freuen, wenn Sie mir mit einem Hinweis weiterhelfen könnten, und bedanke mich schon im voraus ganz herzlich!
Tschüss
A: Es handelt sich um den „Chemischen Garten“. Sie benötigen neben konzentrierter
Wasserglaslösung möglichst große Kristalle von
Kupfer(II)-sulfat, Kupfer(II)-chlorid (-> hellblaugrün)
Calciumchlorid (-> weiß)
Aluminiumsulfat oder Alaun (-> weiß)
Nickel(II)-Salz (-> grasgrün)
Eisen(III)-chlorid oder Eisenalaun (-> gelbbraun)
Eisen(II)-sulfat oder Ammoniumeisen(II)-sulfat (-> hellgrün)
Cobalt(II)-Salz (-> rosa)
Mangan(II)-Salz (-> rosa)
Chrom(III)-alaun (-> violett bis grün)
Achtung: Einige der Substanzen sind gesundheitsschädlich. Wasserglas ist stark ätzend!
Werfen Sie die Kristalle mit einer Pinzette möglichst einzeln und dann auch noch nacheinander hinein (also nicht spatelweise und auf keinen Fall hineinschütten). Je größer die Kristalle sind, desto schöner wächst der Baum. Sonst sieht alles sehr „krautig“ aus. Warten Sie nach jeder Zugabe. Auf diese Weise können Sie zusammen mit Ihrer Tochter das „Wachstum“ besonders gut beobachten.
Die Temperatur sollte gering gehalten werden, damit die Bäumchen nicht durch die Wärmebewegung in der Flüssigkeit zerstört werden. Dennoch können Sie die Lösungen in verschlossenen Gefäßen aufbewahren – aber immer daran denken, dass der Inhalt stark ätzend ist! Außerdem sind die Bäumchen mechanisch empfindlich.
Die Versuche können Sie auch im Reagenzglas zeigen – mit jeweils einer Kristallsorte.
Zur Entsorgung:
Die Lösungen nicht in die Toilette oder ins Waschbecken spülen. Die stark alkalischen Lösungen zerstören die Porzellanglasur – und
zwar augenblicklich!
Falls noch Flüssigkeit drin ist, werden die Gefäße mit Sand oder Erde aufgefüllt, um die Flüssigkeit aufzusaugen. Dann die Gefäße in Plastikfolie einpacken und in den Hausmüll geben.
1557
F: Betreff: Reaktion von Chloroformdampf mit Stahl/Eisen
In einer Destillationsapparatur für Chloroform/Trichlormethan habe ich einen Metall-Rückflusskühler (Dimroth-Kühler) verbaut. Dieser
ist mittlerweile schon ziemlich korrodiert. Haben Sie eine Idee, woran das liegen könnte?
Der Kühler ist aus einem Stahl, welche Sorte weiß ich allerdings nicht. Der Kühler kommt mit Chloroform-Dampf (welcher an der
Kühlschlange kondensiert und abtropft) an Luft in Berührung.
A: Chloroform ist eine erstaunlich wenig stabile Verbindung. Sie spaltet beim Erhitzen gern
Chlorwasserstoff ab. Das wird noch durch Metalloberflächen katalysiert. Zur Erinnerung: HCl ist äußerst wirksames Korrosiv.
Hierzu eine Story: Früher gab es einmal eine Werbeaktion der Gasversorger, um Hausbesitzer zu überzeugen, im Keller statt der Ölheizung eine Gaszentralheizung einzubauen. Man argumentierte, dass man dann ja die Öltanks ausbauen und auf diese Weise eine große Fläche nutzen könnte – zum Beispiel als Werkstatt-Keller. Bald jedoch gab es überraschende Probleme mit den neu eingebauten Gasheizungen: Sie versagten rasch den Dienst, weil die feinen Brennerdüsen korrodierten. Die Erklärung war einfach: Viele Leute arbeiten in der Werkstatt mit Lösemitteln auf CKW-Basis – etwa beim Abbeizen von Holz oder von Metall zur Vorbereitung des Lötens. Die CKW-Dämpfe wurden von der Gasheizung mit der Verbrennungsluft eingezogen und bildeten beim Kontakt mit der heißen Düse HCl. Die Werbekampagne hat man rasch fallenlassen…
1558
F1: Betreff: Warum schimmert Gletschereis blau?
Lieber Herr Blume,
ich habe gerade im ZDF einen Traumschiffverschnitt gesehen. Auf der Reise kamen die Protagonisten in Chile vorbei. Da man die
auffällig blaue Farbe des Gletschereises nicht übersehen konnte, präsentierte einer der Darsteller auch eine vermeintliche Erklärung:
"Das Eis sieht so blau aus, weil Sauerstoff eingeschlossen ist."
Mal abgesehen von der Tatsache, dass Sauerstoff in blauen Flaschen aufbewahrt wird, hat das Gas für mich mit der Farbe blau nichts
zu tun. Im Internet findet man sehr viel unbefriedigenden Quatsch wie z.B. "optische Täuschung, gleicher Effekt wie beim blauen Himmel... usw"
Auf Wikipedia steht zum Thema Eis: „Eis ändert seine Farbe mit dem Luftgehalt und kann so auch in unterschiedliche Gruppen eingeteilt
werden. Eis, das viel Luft enthält, ist weiß, solches, das wenig Luft enthält, ist durchsichtig und blau oder grün."
Wenn ich das richtig verstehe, ist diese Behauptung in etwa das Gegenteil von der im ZDF, zumindest wenn man davon ausgeht, dass das
ZDF Luft meint, wenn es Sauerstoff sagt.
Ich bin nach wie vor noch ratlos. Ordinäres Eis aus dem Gefrierfach oder vom Gartenteich erschien mir bisher immer so farblos, bzw. weiß. Verändern denn Gaseinschlüsse die Farbe? Oder wird tatsächlich Sauerstoff in das Kristallgitter eingebaut? Dass Kristallwasser zu einer Farbveränderung führen kann, ist mir ja aus dem Chemieunterricht vom schönen Kupfersulfat-Versuch bekannt. Da tritt ja auch plötzlich eine blaue Farbe auf....
Vielleicht haben Sie ja eine Ahnung.
Viele Grüße und vielen Dank, (…)
A1: Die blaue Farbe von Wasser und Eis hat nichts mit Luft oder Sauerstoff zu tun. Es wird
auch kaum Sauerstoff ins Kristallgitter eingebaut, denn die Eiskristalle bestehen immer aus Reinwasser. Die Blaufärbung bei der Hinzugabe
von Wasser zu weißem Kupfersulfat hat andere Ursachen (Komplexbildung). Außerdem wird
entsprechend der EU-Richtlinien Sauerstoff nicht mehr in blauen Gasflaschen aufbewahrt, sondern in grauen Flaschen mit weißer Schulter.
Zu Ihrer Frage haben wir eine Webseite. Ich fasse jedoch kurz zusammen: Wasser ist nicht blau, weil das blaue Licht des Himmels gespiegelt bzw. reflektiert wird. Wasser und Eis sind auch dann blau, wenn der Himmel grau ist.
Ursache ist vielmehr, dass Wasser eine starke Infrarotabsorption zeigt (daher seine Wirksamkeit als das Treibhausgas der Erde). Diese Absorption reicht bei großen Schichtdicken auch etwas in den roten, sichtbaren Spektralbereich (unterhalb 750 nm) hinein. Das macht sich bei dicken Wasserschichten (und auch Eis) ab etwa einem Meter bemerkbar; diese absorbieren also rotes Licht.
Die nicht absorbierten Anteile des sichtbaren Lichts addieren nach den Regeln der Farbenlehre zur Komplementärfarbe von Rot, also zu Blaugrün (genau genommen: Cyan). Dieses Licht wird durchgelassen (deshalb erscheint Wasser beim Tauchen blaugrün) oder reflektiert (verantwortlich für die blaue Färbung von wirklich glasklaren Eisbereichen). Hier passt die folgende Zeichnung, die zur Erklärung der Farbwirkung von blaugrüner Lasurfarbe (entspricht hier dem klaren Eis) auf weißem Papier (entspricht dem weißen Hintergrundeis) erstellt wurde:

Wenn Eis dagegen nur weiß erscheint, hat es beim Gefrieren eine Unmenge an großen Luftbläschen eingeschlossen. Deren Oberflächen wirken wie Spiegel und Linsen. Die Eindringtiefe des weißen Lichts ist deshalb gering, also auch seine Absorption von rotem Licht. Deshalb erscheinen das reflektierte Licht und folglich auch das Eis nur weiß.
F2: Danke Herr Blume,
Sie kennen sich ja richtig gut aus. Ich habe unter dem Suchbegriff "Infrarotabsorption Wasser" eine Quelle gefunden, die genau
diese Erklärung bestätigt: www.wissenschaft-technik-ethik.de/wasser_eigenschaften.html.
| Wellenlänge (nm) | k (1/m) | x0,001 (m) |
| 200
250 300 350 400 450 500 550 600 650 700 750 |
ca. 7
ca. 1 ca. 0,2 ca. 0,2 ca. 0,06 ca. 0,02 ca. 0,025 ca. 0,05 ca. 0,2 ca. 0´,32 ca. 0,65 ca. 2,6 |
1
7 35 35 110 350 280 140 35 22 11 2,7 |
Der Faktor k ist eine Art Absorptions- oder Extinktionskoeffizient. Der Wert x0,001 bedeutet die Schichtdicke an Wasser (in Metern), die eingestrahltes Licht der betreffenden Wellenlänge auf 1/1000 der ursprünglichen Intensität abschwächt.
D. h. am roten Ende des sichtbaren Bereichs ist der Absorptionskoeffizient k tatsächlich größer als sonst im sichtbaren Bereich.
Herzlichen Dank für Ihre Antwort.
1559
F1: Betreff: Anfrage zur Extraktion von gelöstem Gold aus Königswasser
Zunächst möchte ich mich bei Ihnen bedanken, dass Sie Ihr Wissen und Ihre Zeit für Chemieinteressierte bereitstellen. Auch wenn
manche Anfrage bei den Kuriositäten landet, oder einzelne Zeitgesellen " ausfällig" werden. Ich hatte Ihre Hilfe vor längerer Zeit
schon einmal in Anspruch genommen, es ging ums verkupfern von Metallen, und erhielt von Ihnen eine aussagekräftige und gute Antwort.
Daher möchte ich Sie heute nochmals um Ihre Hilfe bitten:
Ich habe bereits zu diesem Thema im Internet gegoogelt, mich durch Foren gefragt und auch Ingenieure " interviewt", es kam aber
nichts plausibles, nachvollziebares dabei heraus.
Problem: Eine Handvoll Staub, die mit feinem Goldflitter versetzt ist. Eine Trennung im Wasser aufgrund von Schwerkraft misslang,
Ph Wert Verschiebung und Flockungshilfsmittel geht auch nicht. Dann habe ich aber gelesen, dass ein Chemiker ( bitte nicht nach dem Namen
fragen :-)) ) eine Medaille des Nobelpreises in Königswasser aufgelöst hat, später dann extrahiert und das Gold zurück gegeben hat.
Frage: Wie bekommt man das Gold wieder aus dem Königswasser raus?????
Cyanid- und Amalgamverfahren sind mir zu gefährlich/giftig. In einem Forum bekam ich den Tipp es mit Zinkpulver zu versuchen. Aber
ist das ein guter Tipp?
Ich hoffe nun, von Ihnen eine Auskunft zu erhalten, wie ich dieses Problem lösen kann.
An dieser Stelle möchte ich mich bereits heute für Ihre Hilfe und für die aufgewendete Zeit bedanken
A1: Gold bekommen Sie nicht durch Cyanidlaugerei und Amalgamverfahren aus der Lösung. Das
erstere Verfahren nutzt sogar umgekehrt: Feinverteiltes elementares Gold (etwa aus dem Flusssand) wird in seine lösliche Salzform überführt.
So macht man es zum Beispiel in Rumänien. Beim Amalgamverfahren wird feinverteiltes elementares Gold in Quecksilber gelöst und so aus dem
Boden oder Gestein extrahiert. Man destilliert das Quecksilber ab und erhält einen Goldrückstand. Praktisch wendet man das im Amazonasgebiet an.
Sie haben Gold durch Zersetzung in Königswasser in eine lösliche Goldsalzform überführt. Die Empfehlung, Goldsalze mit Zinkpulver zu reduzieren, ist richtig und entspricht gängiger Praxis bei der Aufarbeitung von Goldsalzen, die z. B. bei der Cyanidlaugerei anfallen.
2 Au3+ + 3 Zn ———> 2 Au + 3 Zn2+
Allerdings entstehen dabei wegen des noch vorhandenen restlichen Königswassers bei Zinkzugabe viele nitrose Gase (Stickoxide), die sehr giftig und dazu noch umweltschädigend sind. Sorgen Sie also für entsprechende Schutzvorkehrungen. Auch kann es passieren, dass das gerade gebildete Goldmetall wieder zersetzt wird. Deshalb sollten Sie sicher sein, dass das Königswasser zuletzt auch wirklich vernichtet ist. Sorgen Sie also für überschüssiges Zink. Nach Abfiltrieren des verbleibenden Festkörpers wird dieser mit Salzsäure behandelt, um das überschüssige Zink zu zersetzen. Zurück bleibt Gold.
F2: Herzlichen Dank für Ihre schnelle Antwort !
Gerne würde ich aber nochmals zu diesem Thema nachhaken. Handelt es sich nach auflösen des Goldes in Königswasser um die viel beschriebene Tetrachlorogold(III) säure?
Durch zusetzen von Zink zu der Lösung reagiert also als erstes das Zink mit der Salzsäure, und erst danach mit dem Gold?
Der Reaktionsgleichung nach geschieht die Umsetzung also ohne Verlust ( Gold ); es werden also "lediglich" Protonen ausgetauscht.
Schutzvorkehrungen:
Ich arbeite seit einigen Jahren als Anlagenführer an einer Pulverbeschichtungsanlage, zu meinen Aufgaben gehört z. B. die Überwachung
von den Vorbehandlungsbädern, sowie auch die Aufbereitung des Abwassers. Auch dies geschieht mittels Chemie.
Tägliche Arbeitsstoffe sind z. B. NAOH, H2SO4, HNO3 mit bis zu 63%, die "guten" Sachen sind dann z. B. 90% Phosphorsäure.
Man arbeitet leicht damit, wenn man Hilfsmittel benutzt, aber NIE leichtfertig. Die entsprechende Laboreinrichtung mit Abzug ist vorhanden.
Herr Prof. Blume, haben Sie vielen Dank für Ihre Auskunft, Sie sind, wie man hier sagt, " ne Wucht"! Vielen Dank!!!!!!
A2: Die sich bildende Substanz ist tatsächlich Tetrachlorogold(III)-Säure H[AuCl4].
Weiter handelt es sich bei Ausfällung mit Zink nicht um einen Prozess unter Beteiligung der Protonen, sondern um die direkte
Redoxreaktion zwischen Zinkatomen und Gold-Ionen (bzw. Goldkomplex-Ionen) – wie ich das letzte Mal geschrieben habe.
Das saure Milieu ist eigentlich gar nicht notwendig. Es fördert jedoch den Prozess, indem es die Oberfläche des Zinks von Oxiden und
Hydroxiden befreit.
F3: Sie haben meine Fragen zur vollen Zufriedenheit beantwortet, als Lehrer würde ich Ihnen
dafür eine 1+ geben!!!
Nochmals vielen Dank für Ihre Mühe !!
1560
F1: Mein Sohn und ich rätseln über der kompletten Gleichung für die Reduktion von KMnO4
mit FeCl2 zu MnO2 und Fe3+ in alkalischer Lösung, also Reduktion von Mn +VII zu Mn +IV (Braunstein) und
Oxidation Fe +II zu Fe +III.
Wir brauchen also schon mal 3 Fe +II, aber wie gleichen wir die freiwerdenden Sauerstoff-Atome mit OH- aus?
Könnten Sie uns helfen?
A1: Die zur Abspaltung der Sauerstoffatome (besser: Sauerstoff-Ionen; formal O2-)
des Permanganat-Ions notwendigen Wasserstoffatome (besser: Protonen) stammen aus den Molekülen des Wassers; dann bleiben die
OH--Ionen zurück:
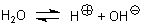
Zur Herleitung der Reaktionsgleichung trennen Sie das Reaktionsgeschehen auf in Reduktion und Oxidation. Noch ein Hinweis: Die Kalium- und Chlorid-Ionen lassen wir weg, denn die nehmen am Reaktionsgeschehen nicht teil und stören nur die Herleitung der Gleichungen.
Reduktion: MnO4- + 2 H2O + 3 e- ——> MnO2 + 4 OH-
Oxidation: Fe2+ ——> Fe3+ + e- (Diese Gleichung mit 3 multiplizieren)
___________________________________________________________________Sie addieren die Gleichungen, wobei die Elektronen herausfallen. Dann ist die gesamte Reaktionsgleichung (Redox-Gleichung):
MnO4- + 2 H2O + 3 Fe2+ ———> MnO2 + 4 OH- + 3 Fe3+
Jetzt können Sie noch die K- und Cl-Ionen dazu schreiben. Das macht aber kein Chemiker. Manche Lehrer verlangen es dennoch:
KMnO4 + 2 H2O + 3 FeCl2 ———> MnO2 + KOH + Fe(OH)Cl2
Sie sehen, was dann für Kuddelmuddel herauskommt - vor allem, weil man die OH--Ionen „unterbringen“ muss.
F2: Haben Sie herzlichen Dank! Der Abend ist gerettet!