 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1636
F: Ich habe gelesen, dass wenn man morgens ein Mohnbrötchen gegessen hat und in
eine Verkehrskontrolle gerät, dass die Polizei dann in meinem Blut Morphium nachweisen kann. Kann das sein?
A: Das stimmt tatsächlich, denn Mohn ist ja die Ursprungspflanze für die Alkaloidgruppe
der Morphine, zu denen vor allem Morphium und dessen Begleitstoff Codein gehören.

(Foto: Blume)
Beim Verzehren von Mohnkuchen oder von Mohnbrötchen sollte das aber nicht weiter schlimm sein. Denn die Mohnsamen enthalten keine Alkaloide. Diese sind vor allem im weißen Pflanzensaft enthalten. Besonders beliebt sind die Mohngebäcke in Dänemark; deshalb gibt es dort weite Felder mit hohen, weißblühenden Schlafmohnpflanzen. Aber achten Sie mal auf Folgendes: Im Randbereich des Felds sind alle Kapseln angeritzt! Grund: Junkies wollen den Saft „ernten“ und dazu ritzen sie vor allem die grünen, also unreifen Kapseln an – wie es die Profis in Afghanistan tun.
Das Problem liegt nun darin, dass beim Ernten die Mohnsamen mit derartig verletzten, mit Saft bedeckten Pflanzenresten und damit mit Morphinen kontaminiert werden. Wenn diese Mohnsamen dann zur Herstellung von Backwaren genutzt werden, kann man schon Morphine in solchen Mengen aufnehmen, die bereits im „therapeutischen Bereich“ (wie das Chemische Untersuchungsamt Ostwestfalen-Lippe schreibt) liegen.
Es gibt daher die Vorschrift, dass der Bäcker die Mohnsamen vor der Verwendung mit heißem Wasser abzuspülen hat, um die wasserlöslichen Morphine abzutrennen. Ob das wohl immer eingehalten wird…?
Das Problem liegt nicht so sehr in Deutschland, sondern in den Ländern, aus denen wir Mohnsamen importieren – wie zum Beispiel Australien. Eine Probe soll 740 mg Morphin/kg Mohnsamen enthalten haben!
1637
F: Die alkalische Wirkung von Ammoniaklösung wird anhand des Lewissäuren-/basenkonzepts
erklärt. Demnach bindet das Stickstoffatom über sein freies Elektronenpaar koordinativ ein weiteres Proton und in der wässrigen
Lösung entstehen OH-Ionen.
Ich glaube es ist für Schüler schwer zu verstehen, warum zum Beispiel das Chlor-atom nicht ebenfalls als Lewis-Base wirkt.
Freie Elektronenpaare hat es ja genug. Aber im Gegenteil: HCl wirkt in Lösung sogar sauer, weil es ein Proton abgibt.
Vielleicht hätten Sie einen Tipp, wie man diese Verständnisschwierigkeit anschaulich ausräumen könnte. Jedenfalls vielen Dank.
A: Gute Frage. Sie ist aber wirklich schwer zu beantworten und erfordert seitens der
Schüler ein gewisses Vorwissen.
Das Cl-Atom ist zwar recht klein, aber größer als das von N. Die Elektronen sind nicht hybridisiert, sondern befinden sich im 2s- und 2p-Zustand. Letztere stehen senkrecht aufeinander. Damit ist wenig Platz für H-Atome, die sich abstoßen würden. Die Bindungslänge ist mit 1,274 Ångström zwar recht lang. Das hat aber auch zur Folge, dass das einzige H-Atom, das andocken kann, besonders locker gebunden ist. Hinzu kommt, dass die Bindungselektronen zwischen H und Cl stark zum Cl gezogen werden. (Die EN von Cl ist größer als die von H.) Es bildet sich ein Dipol aus, der leicht dissoziiert, wenn eine Base wie Wasser hinzutritt.
Das N-Atom ist klein. Typisch für die 1. Reihe des PSE ist Folgendes: Die s- und p-Elektronen sind wie die der Atome von Be, B, C und O weit ausladend sp3-hybridisiert. (Ausnahme F, weil dieses Atom besonders klein ist und dazu noch stark elektronenziehend wirkt.) Diese Orbitale stehen nicht senkrecht zueinander, sondern bilden einen Tetraeder. Obwohl die Bindungslänge von N zu H mit 1,014 Ångström recht kurz ist, gibt es dennoch Platz für das Binden von 3 H-Atomen und dazu noch sogar für ein weiteres H+.
1638
F1: Ich bereite mich gerade auf einen "Tag der Naturwissenschaften" in unserer Schule zu dem Thema
"Indikatoren und pH-Werte" vor. Auf ihrer Seite habe ich mich zum "natürlichen" Indikator Rotkohlsaft informiert und bin dabei auf die
Sache mit den Hortensien gestoßen. Ich nahm - aufgrund einer Information in meinem Chemiebuch - bis jetzt auch an, dass die Blütenfarbe
von dem pH-Wert des Bodens abhängt. Ein ähnliches Phänomen lernte ich vor kurzem beim Fingerhut kennen: der rote Fingerhut soll auf
sauren Böden vorkommen und der gelbe auf basischen. Außerdem sollte es nach dieser Information im Westen (ich nehme an: Europas) vor
allem den roten Fingerhut geben und im Osten den gelben. Kann das stimmen, oder ist das eine erfundene Geschichte? Ich wäre sehr froh,
wenn Sie mir weiterhelfen könnten und danke im Voraus für Ihre Bemühungen!
PS: Ihre Website hat mir schon des Öfteren weitergeholfen und wurde auch von meinem Lehrer wärmstens empfohlen!
A1: Die Sache mit dem Umfärben von Hortensien ist ein alter Trick, den ich
schon von meinen Eltern in unserem Hausgarten in Hameln vorgeführt bekam. Mein Vater grub immer Eisennägel an die Wurzeln der großen
Hortensienbüsche ein. Im nächsten Jahr blühten die dann blau. So machen es heute noch die Gärtner, die allerdings mit Lösungen von
entsprechenden Salzen gießen. Grundlage ist, dass die Fe(III)- bzw. Al(III)-Komplexe der Anthocyane ein anderes Dissoziationsverhalten
und damit bei pH-Wertänderung auch ein anderes Farbverhalten aufweisen als unkomplexierte Anthocyane.
Ihr Gelber Fingerhut dagegen ist eine besondere Fingerhutart (Digitalis lutea). Sie hat besondere Vorlieben wie zum Beispiel kalkhaltige Böden. Die gelbe Farbe hat jedoch nichts mit dem Boden-pH-Wert zu tun. Der Gelbe Fingerhut wird garantiert auch auf saurem Boden gelb blühen. Wir haben übrigens den klassischen, roten Fingerhut (Digitalis pupurea) in unserem Garten – der Boden ist alkalisch…
Noch ein Hinweis: Der pH-Wert des Bodens kann gar nichts mit dem pH-Wert der Zellen und der Zellorganellen zu tun haben, in dem sich die Anthocyane befinden. Lebewesen sorgen durch ein ausgeklügeltes chemisches Puffersystem für konstanten pH-Wert in ihren Zellen. In den Pflanzen können einzelne Zellorganellen recht sauer sein (Vakuolen sogar um pH 4,5). Wenn bei manchen Pflanzen die roten Blüten altern, färben sie sich blau (aber nicht gelb!); dann liegt tatsächlich eine Zunahme des pH-Werts vor. So etwas beobachten Sie beim Lerchensporn oder beim Wandelröschen.
F2: Vielen Dank für die Information! Ich bin froh, dass ich den Besuchern des "Tages
der Naturwissenschaften" jetzt keine Unwahrheiten erzählen werde!
Ich danke Ihnen auch, weil Sie so schnell geantwortet haben!
1639
F: Betreff: Aromatischer Kohlenwasserstoff gesucht
Vorweg möchte ich ein großes Lob für Ihre fantastische Internetseite aussprechen, die mir schon bei etlichen Chemiehausaufgaben sehr hilfreich war. Leider komme ich nun bei folgender Aufgabe, mit der sich unser Chemielehrer für einen mehrwöchigen Krankenhaus-aufenthalt verabschiedet hat, überhaupt nicht weiter:
„Ein aromatischer Kohlenwasserstoff (A) der Summenformel C8H10 wird mit Brom in Gegenwart von Eisen zur
Reaktion gebracht. Dabei entsteht neben Bromwasserstoff nur ein Monobroderivat (B).
Setzt man (A) mit Brom unter Lichteinwirkung um, so entsteht neben Hydrogenbromid ein zu (B) isomeres Monobromderivat (C).
a) Geben Sie die Valenzstrichformeln an, die für (A) in Frage kommen.
b) Formulieren Sie die Reaktionen (A) --> (B) und (A) --> (C) und finden Sie die zu (A) passende Valenzstrichformel heraus. Begründen Sie!“
Mein Wissen im Themenbereich "Substitution am Kern oder in der Seitenkette" ist leider nur sehr begrenzt, so dass ich Sie bitte, mir bei der Beantwortung der Frage zu helfen.
A: Im einfachsten Fall handelt es sich bei (A) um Ethylbenzol.
Es gilt die „KK-SS-Regel“: Katalysator-Kern und Siedehitze-Seitenkette.
1. Mit Fe/Br wird der Kern bromiert (Katalyse). Diese Bromierung hört im Allgemeinen nach einem Reaktionsschritt auf. Hierzu haben wir einen Text zum Thema „Bromierung des Kerns“.
(B) ist also o/p-Ethyl-brombenzol.
2. Mit Energiezufuhr (Licht/Siedehitze) und ohne Katalysator Fe wird nur der Alkylrest bromiert.
(C) ist also Brom-ethylbenzol.
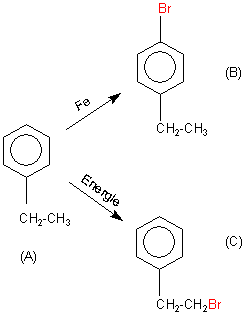
Sie sollten für (A) auch Dimethylbenzol in Betracht ziehen. Da gibt es aber noch die Möglichkeit zur Bildung weiterer Isomere.
1640
F: Ich habe mich heute bei einem Hautkontakt mit Wäschebleiche etwas verletzt. Genauer gesagt
war es so, dass die Flasche unter meiner Spüle stand und wohl Bleiche ausgetreten war. Beim Versuch das Malheur zu entfernen und mit
einem Lappen aufzunehmen kamen meine Hände damit in Kontakt. Sofort begannen alle Kontaktstellen fürchterlich zu brennen und ich bemühte
mich sehr sie wieder von den Händen zu bringen. Es gelang mir schließlich!
Nun zu meinen Fragen:
Wie kann es sein, dass Wäschebleiche eine derart unangenehme Wirkung hat?
Kann es sein dass irgendeine, der Bleiche eigene Reaktion (Aktivierung?) schon vorher durch längeren Kontakt mit Wasser stattgefunden hat? (Stand unter der Spüle wo Wasser schon mal auftaucht)
Zum Produkt: Es handelte sich um die Marke „Domol milde Bleiche“ von Schlecker.
Um eine Beantwortung meiner Fragen wäre ich Ihnen sehr dankbar!
A: Leider kenne ich Ihr Produkt nicht. Aber die Bezeichnung „Milde Bleiche“ ist schon gut,
nach dem, was Sie so berichten…
Was ich jetzt sage, wird wohl für alle derartigen Produkte gelten: Bleichmittel wirken grundsätzlich ätzend und werden als Gefahrstoffe geführt. Auch auf Ihrer Packung wird deshalb das Andreaskreuz als Warnhinweis zu sehen sein.

Einmal wirken Bleichmittel bei Zugabe von Wasser stark alkalisch („basisch“). Außerdem enthalten sie Peroxide, die mit Wasser das eigentliche Bleichmittel, den „Aktivsauerstoff“ produzieren. Das alles reizt Ihre Haut. Wenn die Haut sehr empfindlich ist oder sogar kleine Wunden oder Schrunden aufweist, kann das recht schmerzhaft sein.
Wenn Sie alles wieder abgewaschen haben, sollte der Kontakt keine Folgen für Sie haben. Eincremen mit Heilsalben wie Hametum® unterstützt den Heilungsprozess.
Sie fragen nach der vorgeschalteten Reaktion mit Wasser durch Herumstehen unter der Spüle. Dabei sprechen Sie von einer „Flasche“. Die sollte dicht sein. Vielleicht meinen Sie aber Folgendes: Bleichmittel werden oft in Pappkartons verpackt.
Damit wird eine andere unangenehme Eigenschaft der Bleichmittel deutlich: Sie sind hygroskopisch; sie saugen geradezu Wasser aus der Umgebungsluft an. Das merkt man daran, dass sie bei längerem Stehen zum Klumpen neigen. Der Karton fühlt sich außerdem feucht an. Durch die Feuchtigkeit zersetzen sich die Peroxide, und die Bleichwirkung nimmt ab.
Wenn Sie mit solchen Substanzen arbeiten, sollten Sie immer Gummihandschuhe tragen.