 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1631
F1: Betreff: Brennbarkeit von Ölen
Mir gefällt ihre Seite sehr gut! Ich kenne sie zwar noch nicht lange, aber sie hat mir trotzdem schon eine ganze Menge Fragen beantwortet!
Vielen Dank.
Zu einer Frage habe ich bisher noch keine Antwort gefunden und wollte deshalb wissen, ob sie mir vielleicht helfen könnten.
Ich soll als Hausaufgabe die Brennbarkeit von etherischen Ölen und fetten Ölen vergleichen und erklären.
Ich habe gelesen, dass beide Öle sehr leicht brennbar sein sollen und traue mich deshalb nicht, diese Versuche zu Hause durchzuführen.
Auf ihrer Seite habe ich eine sehr schön sehen können, wie etherische Öle brennen, zu fetten Ölen kann ich leider nichts finden und zu sagen
"sie sind brennbar" reicht denke ich nicht aus. Haben sie vielleicht einen Link wo steht wie fette Öle brennen (Stichflamme, große Flamme etc.)
und warum fette und etherische Öle überhaupt brennen?
Sie würden mir wirklich sehr helfen!
A1: Die genannten Ölsorten brennen beide gut. Genau genommen tun das ihre Dämpfe. Man muss die
Öle deshalb schon gut erhitzen oder für feine Verteilung mittels eines Dochts sorgen.
Es gibt jedoch viele verschiedene etherische Öle mit unterschiedlichen Siedepunkten. Deshalb lassen sich manche etherische Öle leichter
entzünden. Die (Duft-)Lampenöle jedoch fallen nicht darunter.
Typisch ist bei beiden Ölarten das Rußen der Flammen. Stichflammen gibt es wohl nicht – vielleicht, wenn man den Dampf vor dem Entzünden
mit reinem Sauerstoff mischt.
Wir haben zum Brennverhalten Webseiten, auch mit Bildern, beispielsweise zum Thema Friteusenbrand
oder zum Thema Etherische Öle.
F2: Vielen Dank! Sie haben mir sehr geholfen!
1632
F: In den Medien wird aus China von Milchfälschung und dadurch schwer erkrankten Kindern berichtet.
Was hat es mit dem Melamin auf sich? Weshalb wird es der Milch zugefügt?
A: Melamin ist eine Chemikalie, die mit Milch eigentlich nichts, aber auch gar nichts zu tun
hat oder besser haben sollte... Sie wird normalerweise zusammen mit Formaldehyd zur Herstellung von Kunststoffen („Harze“) genutzt,
die den Vorteil haben, dass sie hitzebeständig und sogar feuerfest sind. Man kennt sie von den Zahnputzbechern, aber auch von den
elektrischen Isolierungen. Sie gelten als Duroplaste.
Melamin ist aber letztlich auch von der Biochemie her interessant, denn es wird durch Kondensation von Harnstoff hergestellt. Und das führt uns auf die Spur.
Betrachten Sie die Struktur des Moleküls von Melamin. Es fällt der Stickstoffreichtum auf. Das N/C-Verhältnis ist 6:3. Damit lässt sich trefflich fälschen.
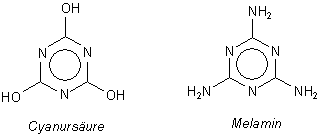
Um nämlich den Proteingehalt von Lebensmitteln zu bestimmen, kann man zum Beispiel den Stickstoffgehalt des Lebensmittels oder das N/C-Verhältnis ermitteln. Der Stickstoffgehalt von Proteinen beträgt durchschnittlich 16,5 %. Das ist zwar eine grobe Analyse, aber sie gibt erste Hinweise. Mit Melamin frischt man diesen Wert kräftig auf.
Dummerweise wird diese Substanz zwar durch den Darm resorbiert, aber im Körper nicht abgebaut. Sie landet in der Niere. Dort reagiert sie mit anderen Harninhaltsstoffen, wie zum Beispiel mit der als Bestandteil von Desinfektionsmitteln genutzten Cyanursäure oder mit (Iso)Cyanursäurechloriden. Mit denen bildet sie schwerlösliche Verbindungen (Molekülkomplexe), die zu Nieren- und Blasensteinen führen. Das Problem der „Proteinstreckung“ ist nicht nur von der Babyernährung her bekannt, sondern schon länger auch aus der Tierernährung.
1633
F: Sehr geehrter Doktor Blume, ich habe viele Ihrer Antworten gelesen, und bin der Meinung
Sie könnten mir meine Frage ebenfalls beantworten. Wie lautet die Zusammensetzung eines Fisch-Aromas (stinkend!), welcher als
Lockstoff für das Angeln von Karpfen verwendet wird? Aufgrund einer Ihrer vorangegangen Antworten habe ich bereits herausgefunden,
dass es Methylamingas ist. Jedoch würde ich es gerne in einer ölig-flüssigen Konsistenz verwenden. Sollten Sie mir weiterhelfen
können, bitte ich um Mitteilung in welchen Variationen dies möglich ist bzw. ob es Fachliteratur dazu gibt und welche, da ich bis
dato ohne Erkenntnis blieb. Vielen Dank im voraus.
A: Es gibt viele Amine, die bei Zimmertemperatur flüssig sind. Triethylamin zum Beispiel
siedet erst bei 89,5 °C, n-Propylamin bei 48,7 °C, n-Butylamin bei 76 °C. Was allerdings in Ihrem Lockmittel drin ist, weiß ich nicht.
Das müsste aber auf der Packung vermerkt sein, denn schließlich handelt es sich bei vielen Aminen durchaus um ätzende Gefahrstoffe.
1634
F: Beim Nachstellungsversuch ihres Experimentes " Prof. Blumes Tipp des Monats Nr. 111
(September 2006)" habe ich eine Farbreihe durch die Veränderung des pH-Wertes von rotem Rosenfarbstoff aufgestellt, dabei ist
bei mir aber die Farbreihe von Pelargonin herausgekommen. Können rote Rosen auch diesen Farbstoff enthalten oder wo könnte
mein Fehler liegen?
Was mich außerdem sehr wundert ist, dass bei der ausschließlichen Zugabe von destiliertem Wasser ein pH-Wert von 5,8 herauskommen
soll nicht von 7. Warum?
A: Den Tipp „Bunte Blumenfarben“ findet man hier.
Zu 1: Es gibt viele Rosensorten mit unterschiedlichsten Farbtönen. Die enthalten züchtungsbedingt entsprechend variierende Farbstoffmischungen. So gibt es auch pinkfarbene auf der Basis von Pelargonin. Gemeint ist die klassisch-dunkelrote Rose…
Zu 2: Zellsaft ist von vornherein sauer. Das gilt auch für das destillierte Wasser, das immer CO2 enthält, also letztlich Kohlensäure.
1635
F: Mein Name ist … und ich schreibe momentan meine Examensarbeit. Unter anderem erarbeite ich,
welche Bedeutung die chemische Wertigkeit noch im Chemieunterricht hat oder ob sie nicht mehr im Chemieunterricht behandelt wird. Muss
man die Wertigkeit im Chemieunterricht einführen und führt sie eventuell zu Fehlvorstellungen bei Schülern? Dazu würde ich mich sehr
über eine Stellungnahme von Ihnen freuen. Ich bitte um baldige Antwort.
A: Es kommt darauf an, was man vorhat – und auf welcher Schulstufe…
Geht es um reine Bindungsbeschreibung im Sinne eines Elektronenaustausches oder um das Aufstellen einer Redoxgleichung, so ist die Wertigkeit von Nutzen. Dann kann man mit Bekanntem wie dem PSE argumentieren, mit der Edelgasschale (usw.). Ich bin also auf jeden Fall für die Beibehaltung der Wertigkeit in der Sekundarstufe I. Dieser Begriff hängt eng mit der Oxidationszahl zusammen.
Wenn man sich Verbindungen jedoch genauer ansieht (also in die Sekundarstufe II wechselt), gibt es Probleme. Ich mache in der Lehre gern einen Unterschied zwischen Wertigkeit und Bindigkeit. Dabei weiß ich nicht einmal, ob es letzteren Begriff offiziell überhaupt gibt… Zur Erläuterung sei an den Stickstoff erinnert. Im Ammonium-Ion ist Stickstoff dreiwertig, aber vierbindig. Beim Nitrat-Ion wird es kompliziert: Die Bindigkeit bleibt aufgrund der Edelgasschalenregel 4, die Wertigkeit bzw. die Oxidationszahl ist 5. Denn für die Schüler leitet sich die Salpetersäure von einem N2O5 ab – egal, welche Struktur das hat… Stickstoff ist immer vierbindig – wobei man wie beim Ammoniakmolekül oder Stickstoffmolekül auch die nichtbindenden Elektronenpaare als potentielle vierte Bindung einbeziehen muss.
Wie gesagt: Die Wertigkeit ist formal und hilft beim Verstehen von Redoxvorgängen; die Bindigkeit erlaubt das Aufstellen von Strukturen – das aber unter Beibehaltung der Wertigkeit. Abweichungen von deren Wert werden in der Struktur durch Ladungen (+) oder (–) ausgeglichen.
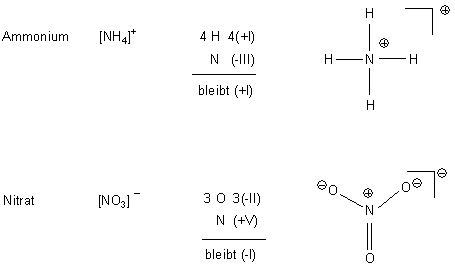
Man sollte natürlich auch noch die nichtbindenden Elektronenpaare der Sauerstoffatome mit berücksichtigen.