 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1711
F1: Hallo Prof. Blume!
Wenn ich die Eisenwolle/stahlwolle anzünde, brennt sie und raucht. Dabei entsteht ja Eisenoxid. Aber was ist dieser Rauch?
Und ist der gefährlich?
Vielen Dank!
A1: Eisenwolle wird, damit sie nicht rostet, mit reichlich Öl imprägniert. Deshalb
eine Frage an Sie: Haben Sie die Eisenwolle vor dem Entzünden gut entfettet, zum Beispiel mit Alkohol/Spiritus? Wenn nicht, ist
Ihnen mit viel Rauch das Öl abgebrannt. Denn brennendes Eisen raucht nicht.
Der Rauch ist nicht weiter gefährlich.
F2: Vielen Dank für die schnelle Antwort. Nein, entfettet war die Eisenwolle nicht.
Womit wird sie denn gefettet? Mit Speiseöl oder Mineralöl?
A2: Natürlich mit Mineralöl, also letztlich mit Kohlenwasserstoffen. Fette Öle, die
Sie aus der Küche kennen, zersetzen sich sehr rasch (vor allem auch unter Mitwirkung von Mikroorganismen). Dabei bilden sich
Fettsäuren, die erst recht korrosionsfördernd wirken.
F3: Hallo Prof. Blume,
vielen Dank für ihre freundlichen Antworten.
1712
F1: Zur Zeit besuche ich die 11. Klasse des …Gymnasiums in …. Ich halte bald ein Referat
über das Thema "Konservierung mit Alkohol", aber auf die Frage, warum bzw. wie genau überhaupt Ethanol konservierend wirkt, habe
ich bis jetzt noch keine zufrieden stellende Antwort gefunden.
Bisher habe ich herausgefunden, dass Ethanol ab einer Konzentration von 14% konservierend wirkt, das "Überleben" von Mikroorganismen (Bakterien, Hefen, Schimmelpilze, Enzyme) unmöglich macht und somit dann die natürlichen Zerfallprozesse verhindert. Höherprozentiger Alkohol denaturiert die Zellmembranproteine und macht bspw. Bakterien oder Pilze unschädlich bzw. inaktiviert sie irreversibel, also unumkehrbar.
Aber wie lässt sich der Konservierungsvorgang chemisch erklären, z.B anhand eines präparierten Insekts in Alkohol oder eingelegter Früchte mit Zucker in Alkohol (Rumtopf)?
A1: Hier geht es letztlich eigentlich nur um physikalische Effekte.
Sie müssen erst einmal Konservierung genau definieren. Das heißt nur Haltbarmachung von Lebensmitteln (und biologischen Präparaten).
Es gibt viele Ursachen für die Verderbnis von Lebensmitteln und Präparaten. Vor allem sind das in erster Linie endogene Prozesse, also solche, die einsetzen, wenn totes Gewebe ohne Einwirkung von Mikroorganismen verdirbt - man sagt: es verwest. Das ist auf die Tätigkeit von körpereigenen Hydrolasen zurückzuführen. Diese Enzyme benötigen Wasser zu ihrer Reaktion, und mit Alkoholzusatz von 14 % wird deren Tätigkeit eingeschränkt.
Die Konservierung betrifft weiter auch den Schutz vor Angriff durch Mikroorganismen wie Bakterien oder Pilze (Schimmel und wilde Hefen). Die uns bekannte Form von Leben benötigt Wasser. Ethanol stört als halbwegs wasserähnliches Molekül diese Prozesse. Zum Beispiel lösen sich Salze gut in Wasser. Wenn aber Alkohol hinzutritt, wird das Lösemittelgemisch unpolarer, und es löst sich weniger Salz. (Das können Sie zeigen: Kochsalz löst sich nur ganz wenig in Ethanol.) Das kann bei Organismen zu Mineralienmangel führen.
Hinzu kommt, dass Ethanol als gutes Lösemittel Biomembranen angreift. Diese bestehen aus einer Lipid-Doppelschicht. Besonders ausgeprägt ist das bei den Nervenzellen. Darauf beruht auch die Wirkung von Alkohol als Narkotikum („Koma-Saufen“).
Viren greifen jedoch kein totes Gewebe an, wirken also nicht verderbend auf Lebensmittel. Denn sie sind keine Lebewesen, sondern nur „wild gewordene Gene“, die zur Vermehrung ausschließlich auf die Stoffwechselleistungen ihrer Wirtsorganismen angewiesen sind.
Ähnliches gilt für Desinfektion mit höherprozentigem Alkohol (um die 70 %). Das hat u. a. auch den Grund, Fette von Oberflächen zu lösen und damit gleichzeitig Bakterien, Pilze und Viren abzuspülen. Das macht man zum Beispiel mit der Haut, wenn man eine Spritze setzen will oder einen chirurgischen Schnitt führen muss.
Zu Ihrer Frage hinsichtlich der eingelegten Früchte: Hier ist der Alkohol weniger als Konservierungsstoff, sondern darüber hinaus als Genussmittel zu verstehen…
F2: Ich möchte mich nochmal bei ihnen für die kompetente Hilfe bedanken. Sie haben einige
Unklarheiten beseitigt.
Heute habe ich das Referat gehalten und wie es aussieht bekomme ich dafür eine passable Note :)
1713
F: Können Sie mir sagen, was die E-Nummern auf dieser Zutatenliste bedeuten?

A: Das sollte nicht schwer sein. Die E-Nummern
(Europa-Nummern) bedeuten:
E 300 Ascorbinsäure (wirkt als Säuerungsmittel und als Konservierungsstoff (Antioxidans); ist identisch mit Vitamin C und wertet den Gemüsemix deshalb besonders auf)
E 330 Citronensäure (nahrhaftes Säuerungsmittel)
E 621 Glutaminsäure bzw. Glutamat (gilt als Geschmacksverstärker, unterstützt die neue Geschmacksnote Umami; vergleiche Frage 1314)
E 954 Saccharin (ein technisch hergestellter Süßstoff)
1714
F: Mich beschäftigt der Begriff "Hydrid". Häufig liest man, dass beim Eindiffundieren von
Wasserstoff in ein Metall, z.B. in Titan, ein Metallhydrid vorliegt.
Hierzu meine Frage: ist es nicht so, dass - solange der atomare Wasserstoff in geringen Konzentrationen interstitiell im Gitter
eingelagert ist - noch kein Hydrid, sondern nur ein gelöster Zustand (wie z.B. C in Fe) vorliegt und dass ein Hydrid sich erst bei
höheren (stöchiometrischen) H-Konzentrationen bildet und hierzu erforderlich ist, dass sich - wie bei allen intermediären Verbindungen
- kovalente und ggf. Ionenbindungscharakteristiken zwischen dem Wasserstoff und seinem metallischen Partner ausbilden?
Meines Wissens scheiden sich Metallhydride regelrecht als flache Gebilde im Gitter aus.
Falls meine Aussagen oben korrekt sind, sollte man also beim Vorliegen eines Wasserstoffanteils im Metallgitter nicht automatisch
von einem Metallhydrid sprechen dürfen.
A: (Von Manfred Kuballa) Sie sind zu Recht auf einen Widerspruch bei der Bezeichnung
"Hydrid" gestoßen. Im eigentlichen Sinn sind Hydride Verbindungen von Wasserstoff und Elementen aus der 1. bis 3. Hauptgruppe des
Periodensystems, wobei die Alkalimetallhydride wie Salze eine ionische Struktur besitzen, in der Wasserstoff als negativ geladenes Ion
(H-) auftritt. Daher auch die Bezeichnung "Hydrid" in Anlehnung an Halogenid usw. Dieser ionische Charakter geht von der 1. zur 3.
Hauptgruppe zunehmend in einen molekularen Charakter über. So liegen in den Borhydriden (Borane) eindeutig Elektronenpaarbindungen vor.
Soweit zu den eigentlichen Hydriden, die eine definiert stöchiometrische Zusammensetzung haben.
Nun gibt es, wie Sie richtig anmerken, eine andere Gruppe von Metall-Wasserstoff-Systemen, bei denen Wasserstoffatome im Zwischengitter
von Metallen eingelagert sind. Diese Produkte nennt man merkwürdigerweise auch Hydride, obwohl sie mit den eigentlichen Hydriden nichts zu
tun haben. Die Zusammensetzung ist auch nicht stöchiometrisch, sondern hängt vom jeweiligen Partialdruck der das System umgebenden
Wasserstoffatmosphäre ab: Je höher der Druck, desto mehr Wasserstoff löst sich im Zwischengitter. Eine definiert stöchiometrische
Zusammensetzung wird dadurch jedoch nicht erreicht. Sobald der Druck nachlässt, diffundiert der Wasserstoff bis zu einem bestimmten
temperatur- und druckabhängigen Lösungsgleichgewicht wieder aus dem Gitter. Klassische Beispiele sind Hydride der Platinmetalle, aber
auch andere, wie z. B. die sehr komplex aufgebauten Metalllegierungen beim Nickel-Metallhydrid-Akku. Im letzten Fall dient das
Metallgitter quasi als Wirtsgitter für eine "Wasserstoff-Elektrode".
Fazit: Der Name "Hydrid" wird für zwei Systeme verwendet, die - chemisch gesehen - nichts miteinander zu tun haben. Aber solche
Widersprüchlichkeiten gibt es ja auch an anderer Stelle: Reine Schwefelsäure H2SO4 ist nicht sauer, warum heißt
dann HCl nicht Salzsäure, sondern Chorwasserstoff?
1715
F: Ich habe folgende Frage:
Man hat 1 L einer Säure mit dem pH = 4 bzw. pOH = 10. Man verdünnt mit Wasser auf 10 L, dann sinkt der pH auf 5 bzw. pOH wird 9,
d.h. die Hydroxidionenkonzentration ist jetzt höher.
Wie erklärt man das Ansteigen der Hydroxidionenkonzentration auf der Teilchenebene, oder wo liegt mein Denkfehler?
A: Da ist kein Denkfehler zu entdecken. Höchstens, dass der pH-Wert beim Verdünnen der
Säure von 4 auf 5 steigt, die Konzentration der Säure sinkt.
Wenn der pOH-Wert von 10 auf 9 sinkt, steigt die Konzentration der OH--Ionen. Wenn Sie die Konzentration von Säure verringern, müssen logischerweise auch mehr OH--Ionen vorliegen. Denn die werden aus dem Wasser in dem Maße nachgebildet, wie es das Ionenprodukt fordert.
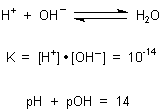
Denken Sie auch einmal „rückwärts“. Steigern Sie umgekehrt die Konzentration an Säure von pH 5 auf 4, so gibt es mehr Protonen, die mit überschüssigen OH--Ionen zu Wasser reagieren. Damit sinkt deren Konzentration, entsprechend gilt pOH 9 -> 10.