
Antioxidantien in Lebensmitteln
Experimente:
Versuch: "Trocknen" von Leinöl
Versuch: Säuren als Antioxidationsmittel

Wenn Fette Öle so aussehen, wird es Zeit, sie zu entsorgen... Was macht sie so fest?
(Foto: Daggi)
Antioxidantien schützen Lebensmittel vor Oxidation. Da diese Oxidation in
Anwesenheit von molekularem Sauerstoff ohne Zutun anderer Substanzen abläuft,
spricht man auch gern von Autoxidation. Gesprochen wird das übrigens Aut-Oxidation.
Wie die Autoxidation wirkt, können wir anhand der Verfestigung von offen
stehendem Leinöl beobachten (-> Versuch). Dabei reagieren die
CH2-Brücken neben oder zwischen den Doppelbindungen der Ölsäure, indem sie
Peroxide bilden. Diese können sogar explodieren und Küchenbrände auslösen (->
Webseite).
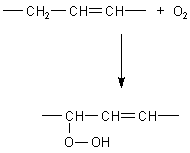
Anschließend kommt es durch komplizierte Reaktionen, an denen auch Radikale beteiligt sind, zu Quervernetzungen zwischen den Fettmolekülen, die zur Verfestigung des Fetts führen.
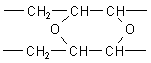
Unterstützt wird der Prozess durch Schwermetall-Ionen bzw. deren Salzen, die man treffend Sikkative nennt (lat. siccare, trocknen). Davon machten auch die alten Maler Gebrauch, als sie ihre Ölbilder malten. Hier wirken Citronensäure und Weinsäure. Sie bewirken nicht nur ein saures, oxidationsschützendes pH-Milieu, sondern wirken als Komplexbildner durch Abfangen der sikkativ wirkenden Metall-Ionen.
(Diese Verfestigungsvorgänge darf man nicht mit der Fetthärtung von fetten Ölen verwechseln! Bei der härtet man fette Öle, indem man Wasserstoff in Gegenwart von Hydrierkatalysatoren wie Nickel an die Doppelbindungen der ungesättigten Fettsäuren addiert.)
Gelingt es, den Sauerstoff fernzuhalten, so können diese Reaktionen nicht ablaufen. Das macht man mit sauerstoffempfindlichen Chemikalien, mit den Antioxidantien, die nach EU-Recht zugelassen sind. Sie zählen aber nicht zu den "Zusatzstoffen". Hier ist die Gruppe der Antioxidantien aus der E-Liste.
| ANTIOXIDANTIEN | |
| E 300 | - L-Ascorbinsäure |
| E 301 | - Natrium-ascorbat |
| E 302 | - Calcium-ascorbat |
| E 304 | - 6-Ascorbyl-palmitat |
| E 306-309 | - Verschiedene Tocopherole (Vitamine E) |
| E 307 | - DL-alpha-Tocopherol |
| E 310 | - Propyl-gallat |
| E 311 | - Octyl-gallat |
| E 315 | - Iso-ascorbinsäure |
| E320 | - Butyl-hydroxy-anisol (BHA) |
| E 321 | - Butyl-hydroxy-toluol (BHT, meist verwendet in Kaugummi) |
Vitamin C und Vitamin E - ein synergistisches Paar
An prominenter Stelle finden wir die Ascorbinsäure mit ihren Salzen und mit ihrem
Palmityl-Ester. Wie wirken die?
Die Ascorbinsäure spielt das Reduktionsvermögen ihrer Endiolgruppe
aus.
Man setzt Vitamin C üblicherweise zusammen mit den Tocopherolen (Vitamin E)
ein. Bei denen handelt es sich um eine Gruppe von hochungesättigten Phenolen bzw. Chinonen mit
einer langen Kohlenwasserstoffkette; diese Moleküle sind wie geschaffen zum
Radikalabfangen, da sie leicht Radikale bilden und Radikale
vernichten. (Das steht auch im Zentrum der Werbung für Vitamin E.)
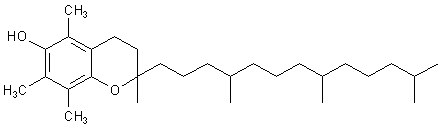
a-Tocopherol
(Tocopherol ist übrigens ähnlich aufgebaut wie die Flavonoide, Anthocyane
sowie Catechine, denen man ebenfalls Radikalfang-Eigenschaften nachsagt.)
Mit der Ascorbinsäure scheint es einen verstärkenden Effekt zu geben (Synergismus). Auch wenn man die Mechanismen noch nicht gänzlich verstanden hat, so meint man sagen zu können, dass die Ascorbinsäure mit den Tocopherol-Radikalen zu Dehydroascorbinsäure reagiert und dadurch die empfindlicheren Tocopherole wieder "aufladen". Hier spielen vor allem auch die schon angesprochenen radikalischen Mechanismen der Ascorbinsäure eine Rolle.
2 Tocopherol· + AscH2 ———> 2 TocopherolH + Ascox
Besonders hilfreich beim Schutz von Fetten vor Autoxidation ist ein Fettsäureester
der Ascorbinsäure, die 6-Palmitoyl-Ascorbinsäure. Diese Ascorbylpalmitat hat die
Eigenschaften eines Tensids, also eines oberflächenaktiven Stoffs. Der
Palmitoyl-Rest ankert im Fett, während der hydrophile Ascorbinsäure-Kopf nach
außen ragt. Dieser Kopf unterbindet den Zutritt von Sauerstoff.
(Der Palmitinsäureester wird übrigens durch Lipasen im Darmtrakt gespalten.)
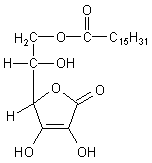
6-Palmitoyl-L-ascorbinsäure
Die anderen Antioxidantien
Gallate sind Fettsäureester der Gallensäure.
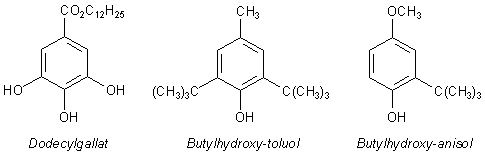
Die Butylhydroxy-Verbindungen (...-Toluol, ...-Anisol) sind ebenfalls Phenole. Ihr Butylrest ist genau genommen ein Tertiärbutylrest. Die Verbindung des Toluols ist also Di-tertiär-butyl-p-hydroxy-toluol. Die Stoffe haben Ähnlichkeit mit dem Tocopherol und wirken deshalb ähnlich.
Diese Phenole bilden leicht relativ stabile Radikale, da diese wegen des aromatischen Ringsystems mesomeriestabilisiert sind.
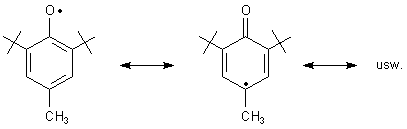
Sie sind deshalb auch hochwirksame Scavenger, also Radikalfänger. Das funktioniert im Wesentlichen auf zwei Wegen, die wir am Beispiel des Butylhydroxy-toluols erläutern.
Reaktionstyp 1: AH + R· ———> A· + RH
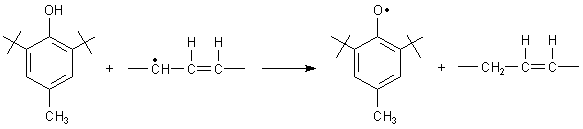
Reaktionstyp 2: A· + R· ———> AR
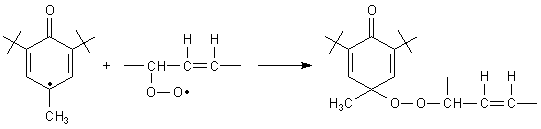
Catechin-Gerbstoffe
Für Pflanzen und vielleicht auch für den Menschen wichtige Antioxidantien sind die Catechine, phenolische
pflanzliche Gerbstoffe. Sie sind strukturell mit den Antocyanen verwandt. Über die Rolle der Catechine
berichten wir im Zusammenhang mit der Laubfärbung im Herbst.
Weitere Texte zum Thema „Ascorbinsäure“