 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1731
F: NM VOC spielen wie bekannt eine herausragende Rolle bei der anthropogen bewirkten
Entstehung bodennahen Ozons. Ich habe versucht Infomationen über NM VOC zu finden, habe jedoch keine allgemeine Strukturformel
für diese leicht flüchtigen organischen Kohlenwasserstoffe gefunden.
Ich würde mich über eine Antwort sehr freuen. Vielen Dank im Voraus.
A: NM VOC steht für Non-Methane Volatile Organic Compounds.
Darunter versteht man organische Verbindungen, die bei unseren Temperaturen und Luftdrucken gasförmig vorliegen oder leicht verdampfen.
Stofflich kann man (außer der beschriebenen physikalischen Eigenschaft) nichts Allgemeines festmachen, also auch keine allgemeine
Formel angeben.
Denn das kann alles Mögliche sein! Zunächst sind die Lösemittel zu nennen, die man zum Beispiel beim Lackieren benutzt. Es handelt sich um Ester, Ether, Ketone, etherische Öle und auch Kohlenwasserstoffe. Dazu kommen Benzinanteile, Schwefelverbindungen, HalKW und so weiter. Interessant ist, dass auch Algen große Mengen derartiger Stoffe freisetzen.
Methan hat man aus dieser Gruppe von Substanzen herausgenommen, da es wegen seiner großen Konzentrationen eine besondere, genau definierbare Bedeutung hat.
1732
F: Ich nutze mit Freude Ihren Bildungsserver für Chemie und hätte eine Frage in Bezug auf
bodennahes Ozon:
Ist es wahr, dass bodennahes Ozon in seinen Konzentrationen durch Niederschläge von Regen minimiert wird bzw. ausgewaschen wird? Wie wirkt sich dann die mögliche Reduzierung troposphärischen Ozons durch Regen in den Konzentrationen aus, ist also eine erhebliche Abnahme der Konzentration bodennahen Ozons durch Regen verbunden?
A: Ozon wird tatsächlich ausgewaschen, auch wenn es nicht besonders gut wasserlöslich ist.
Aber man muss bedenken, dass Ozon kaum entsteht, wenn Regenwetter ist. Denn zur Entstehung von bodennahem Ozon sind Hochdruckwetterlage
und Sonnenschein notwendig. Entfallen diese, so läuft die Ozonbildungsreaktionskaskade in Richtung auf Ozonzersetzung durch in der
Luft befindliche Schadstoffe - wie in der Nacht. Klicken Sie hier.
1733
F: Ich bin Schüler einer 10. Klasse (Gymnasium). Ich habe vielleicht eine Frage, die nicht so
ganz in den Serverinhalt passt, trotzdem stelle ich sie jetzt: Warum sind manche Elemente radioaktiv?
Ich bedanke mich bei Ihnen für Ihre Mühe und hoffe auf eine schnelle Antwort.
A: Gute Frage… Aber ich kann es dir gleich sagen: Man weiß es noch nicht so genau.
Atomkerne sind aus Teilchen (Nukleonen), das heißt aus Protonen und Neutronen aufgebaut. Die Protonen stoßen einander ab, die Neutronen nicht. Folglich sollte es große Kerne gar nicht geben. Man fasste die Neutronen früher deshalb als eine Art Zwischensubstanz auf, die die Protonen einmal auf Abstand, andererseits aber auch wie Kitt zusammenhält. So wäre ein Aufbau von stabilen Atomkernen mit über 100 Protonen und beliebig vielen Neutronen denkbar - was bekanntlich auch nicht stimmt.
Dann sagte man, dass ein bestimmtes Verhältnis von Protonen und Neutronen nicht über- oder unterschritten werden dürfe, sonst gäbe es den Zerfall. Das stimmt leider auch nicht immer.
Entscheidend für die Stabilität von Atomkernen ist eine Energiegröße, die Kernbindungsenergie, die frei wird, wenn sich Atomkerne aus Protonen und Neutronen bilden. Je größer diese Energie ist, desto stabiler sind die Kerne. Man kann aber auch damit nicht alles erklären.
Nach moderner Anschauung muss man davon ausgehen, dass die Atomkerne (wie auch die dir sicherlich bekannte Elektronenhülle der Atome) schalenartig aufgebaut sind. Dabei gibt es Protonenschalen und Neutronenschalen. Jede volle Schale entspricht einer stabilen Nukleonenzahl. (Bei den Elektronenschalen spricht man von Edelgasschalen.) Wenn diese entsprechende Atomkernschalenzahl erreicht ist, ist der Atomkern stabil. Wird diese Zahl aber über- oder unterschritten, kommt es zu einer Deformation des Atomkerns. Die Folge extremer Deformationen ist der Zerfall des Atomkerns, also Radioaktivität.
Beim Energieaustausch zwischen den Atomkern-Schalen spielen übrigens die „Quarks“ eine wichtige Rolle. Sie sind sozusagen die Kernenergie-Lichtquanten. Man ordnet ihnen übrigens deshalb auch (formal) eine „Farbe“ zu.
1734
F: Wir haben in der Chemie-AG unserer Schule versucht, das Verbrennungsexperiment Silizium
plus Sauerstoff durchzuführen, sind aber auf einige Hindernisse gestoßen. Die Reaktion lief nicht ab. Jetzt wollten wir fragen, wie
Sie denken die Reaktion denn vielleicht ablaufen könnte. Wir haben reines Silizium in den Brenner gehalten.
A: Silicium verbrennt als unedles Halbmetall sehr wohl - aber erst bei Temperaturen, die
deutlich über 1000 °C liegen. Seine Verbrennungsenthalpie ist sogar sehr hoch - etwa 2,5 Mal größer als die von Kohlenstoff, die
394 kJ/mol beträgt.
Si + O2 ———> SiO2 + 912 kJ/mol
Der Grund für das von euch beobachtete Verhalten ist, dass das entstehende Siliciumdioxid auf dem Silicium einen dichten Belag bildet und den Zutritt von weiterem Sauerstoff erschwert. Letztlich ist SiO2 ja nichts anderes als Quarz. Die hohe Temperatur dient also zur Aktivierung.
Man spricht von Passivierung. Das zeigen auch andere Elemente wie z. B. Aluminium, Zinn oder Titan.
1735
F1: Ich melde mich bei Ihnen auf Vorschlag meiner Chemielehrerin.
Ich besuche zurzeit die 12 Klasse des Gymnasiums. In der Klausur des Grundkurses hatten wir die Aufgabe zu dem Stoff mit der
Summenformel C2H4O2 drei mögliche Strukturformeln zu entwickeln. Nachdem ich 2 logische und
richtige Strukturformeln entwickelt hatte, bildete ich auch noch die Folgende:
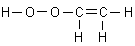
Diese erschien mir richtig, da ja alle Atome ausreichend Bindungen haben.
Meine Lehrerin jedoch zählte sie nicht als richtig, da ihrer Meinung nach die Gruppe/Bindung "H-O-O" nicht existent sei und
sagte mir, dass wenn ich ihr die Existenz nachweisen würde, Sie die Strukturformel als richtig anerkennen würde.
Meine Frage an Sie lautet folglich, ob diese Strukturformel möglich ist.
A1: Diese Struktur gibt es nicht bei stabilen Verbindungen. Neben einer C-C-Doppelbindung
kann Ihr Peroxid nicht bestehen, da es sich sofort zum Glykolaldehyd umlagern wird.
Grund für deren Nichtexistenz ist aber nicht, dass es keine H-O-O-Gruppe gibt; die kennt man als Peroxogruppe. Sie leitet sich letztlich vom Wasserstoffperoxid H2O2 ab - analog wie die H-O-Gruppe eines Alkohols vom Wasser H2O.
Organische und anorganische Peroxoverbindungen H-O-O-R sind sehr wichtig, zum Beispiel als Sauerstoff liefernde Bleichmittel in der Waschmittelindustrie oder bei den so genannten radikalischen Polymerisationen.
Es reicht also zum Aufstellen einer Strukturformel nicht aus, dass alle Bindungen richtig abzuzählen sind. Hier sind die drei realen Möglichkeiten zur Isomerie von C2H4O2:
1. Essigsäure CH3-COOH
2. Glykolaldehyd CH2OH-CHO
3. Ameisensäuremethylester (= Methylformiat) H-COO-CH3
F2: Vielen Dank für diese schnelle Antwort und auch ausführliche Erklärung.
Ich bin wirklich begeistert von ihrem Angebot und werde bei eventuell anderen Problem auf ihre Seite zurückkommen.