 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1736
F1: Ihre Homepage ist unheimlich hilfreich für die Unterrichtsvorbereitung!
Ich habe jedoch eine (hoffentlich) kurze Nachfrage: Was genau ist der Unterschied zwischen Cyanin und Cyanidin?
A1: Cyanidin ist das freie Molekül des Farbstoffs.
Cyanin ist das Glykosid von Cyanidin, also das mit (zwei) Zuckerresten behängte Molekül.
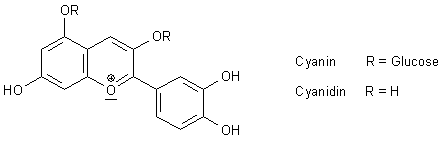
Farblich gibt es keine Unterschiede, wohl aber hinsichtlich der Löslichkeit. Klicken Sie hier.
F2: Vielen Dank für Ihre Hilfe - Sie haben mir sehr weitergeholfen.
1737
F: Lieber Herr Blume,
im Unterricht haben wir weißes Kupfersulfat mit Wasser reagieren lassen. Bei ca.70 % der Klasse entsprach die exotherme
Energie, die Temperatur des Produktes der Anfangstemperaturen beider Stoffe.
Beispiel:
20° C warmes Wasser + 30 °C warmes weißes Kupfersulfat -> 50 °C Exotherme Energie
Nun meine Frage:
Hat die Anfangstemperatur der beiden Stoffe die oben geschilderte Auswirkung auf die Exotherme Energie?
Ich hoffe, Sie können die Frage beantworten, da die Antwort sogar unser Lehrer nicht wusste.
A: Meinst du „die Summe der Anfangstemperaturen“?
So einfach geht es nicht… Was bei euch gemessen wurde, ist reiner Zufall.
Probiert zunächst einmal Folgendes aus: Mischt gleiche Mengen (z. B. je 50 ml) von Wasser mit 20 °C und mit 30 °C. Ergebnis: Die Mischungstemperatur ist nicht 50 °C, sondern 25 °C!
Rechnung:
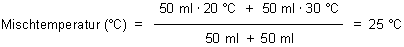
In eurem Versuch kommt es darauf an, „wie viel“ Wasser ihr mit „wie viel“ Kupfersulfat mischt. Die optimale Energieausbeute habt ihr, wenn ihr „stöchiometrische Mengen“ zusammengebt. (Dann habt ihr auch die höchste Temperatur.) Die Zusammensetzung der Mischung ermittelt ihr mit Hilfe der chemischen Reaktionsgleichung.
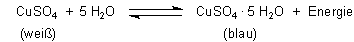
Z. B. kann man 159,5 g weißes Kupfersulfat und 90 g Wasser zusammengeben - oder ca. 16 g Kupfersulfat und 9 g Wasser (und so weiter). Man spricht von molaren bzw. stöchiometrischen Mengen. Dabei muss man darauf achten, dass beide Substanzen die gleiche Temperatur haben.
Achtet weiterhin auch noch darauf, dass ihr Energie und Temperatur nicht in einen Topf werft.
1738
F: Wir haben versucht, mit Spinnengewebe den Biuretnachweis zu machen. Es reagierte nicht. Aber
die Spinnenfäden bestehen doch aus Protein?
A: Sie bestehen aus verschiedenen Proteinen vor allem mit Faltblattstruktur. Jeder Faden
ist mit einem Mantel von Phosphat umgeben, so dass die üblichen Proteinnachweise wie die Biuretprobe
nicht funktionieren. Die Kupfer-Ionen werden wohl eher als Phosphat gebunden, als dass sie mit den Peptidbindungen die bekannten
purpurfarbenen Komplexe bilden. Das Eiweiß ist also regelrecht abgeschirmt.
Der Phosphatmantel, der von der Spinne bei der Fadenherstellung als letztes aufgetragen wird, schottet die Proteine außerdem so stark nach außen ab, dass sich deren Wasserstoffbrücken nach innen absättigen müssen. Das ist einer der Gründe für die extreme Stabilität der Spinngewebsfäden.

Spinnengewebe (Foto: Blume)
1739
F: Ich hatte ursprünglich meinen Chemielehrer gefragt, doch dieser verwies mich mangels
einer Antwort auf meine Frage an sie.
Also: Warum werden Bananen im Kühlschrank braun oder besser, warum wird die Schale braun? Die Banane nimmt äußerlich bei der
niedrigen Temperatur eine braune Färbung mit einem leichten Grünstich an (den Grünstich bemerkt man besonders gut, wenn man die
Banane aus dem Kühlschrank mit einer bei Zimmertemperatur gereiften vergleicht). Dabei reift das Innere der Banane kaum nach.
Welche Reaktion läuft im Kühlschrank in der Bananenschale/in der Banane ab?
Ich würde mich sehr über eine Antwort freuen!
A: Bananen werden braun, weil sie mit Hilfe von Sauerstoff und einem Enzym aus Gerbstoffen
(letztlich aus Phenolen) braune Farbstoffe bilden. Das Enzym heißt Phenoloxidase. Die Bräunung tritt vor allem ein, wenn die Banane
verletzt (z. B. gequetscht) wird. Die Phenoloxidase soll dem Oxidationsstress der Frucht entgegenwirken, also das Eindringen von
Sauerstoff ins Gewebe verhindern.
Starke, anhaltende Kühlung ist für eine reife, warme Gefilde gewöhnte Banane ebenfalls eine Art Verletzung, die mit großflächiger, fleckiger Bräunung der Schale beantwortet wird. Da die Schale (anders als bei einer Quetschung) unverletzt ist, ist die Bräunung nur äußerlich - wegen des drinnen fehlenden Sauerstoffs.
Aber auch beim Reifen beobachtet man das, vor allem, wenn die Banane aus der „Hand“ abgeschnitten wird, ohne dass das Innere verletzt wird.

(Foto: Blume)
Diese Reaktionen zeigen auch Äpfel und Birnen. Das Braunwerden der Blätter im Herbst beruht ebenfalls auf der Wirkung von Phenoloxidasen.
1740
F: Ich habe eine Batterie gebastelt mit Kohle und Alu-folie (100x100mm Platten) als Elektroden
und als Elektrolyt nahm ich Salzwasser.
Nach ein paar Tagen bekam die Folie ein Loch, wurde sozusagen vom Salzwasser angefressen.
1)Kann dies irgendwie verhindert werden?
2)was entsteht chemisch gesehen?
3)wenn ich eine dicke Folie nehme (etwa 1mm dick) wie lange wuerde es dauern bis diese ein Loch bekommt?
A: Sie haben eine Batterie hergestellt, die darauf beruht, dass das unedle Aluminium
zersetzt wird. Die dabei freigesetzten Elektronen wandern zur katalytisch wirkenden Graphitelektrode, die sie auf Sauerstoffmoleküle
überträgt. Solche Batterien kennt man unter dem Begriff Luft-Elemente. Satt Aluminium nimmt man z. B. Zink (Zink-Luft-Element).
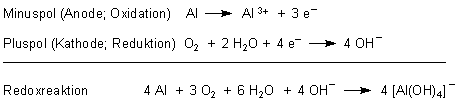
Es handelt sich hierbei letztlich um die Sauerstoffkorrosion von Aluminium und entspricht durchaus dem katalysierten Rosten von Eisen. Eine entsprechende Batterie können Sie sich auch mit einem Teelichtbecher bauen.
Durch das Salzwasser wird der Stromkreis geschlossen, da es elektrisch leitet. Das Salzwasser ist somit der Elektrolyt. Hinzu kommt noch, dass Chlorid-Ionen die Korrosion des Aluminiums katalytisch fördern.
Die Betriebsdauer hängt davon ab, wie viel Strom Sie der Batterie entnehmen. Ob, wann und vor allem wo sich ein Loch bildet, kann man nicht voraussagen. Eine gleichmäßige Abnutzung können Sie nicht erzielen, weil die Metallbleche zu uneinheitlich aufgebaut sind. Denn die Zersetzungseffekte sind abhängig von der mikrokristallinen Beschaffenheit der Oberfläche.