 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1741
F: Schülerinnen sind im Rahmen einer Jugend forscht Arbeit an mich herangetreten mit
der Frage was passiert wenn zwei Silberelektroden in Wasser an eine Spannungsquelle angeschlossen werden. Nach Recherche muss
dabei sog. Silberwasser entstehen. Mir ist jedoch unklar, welche chemischen Reaktionen während dieser Elektrolyse genau ablaufen.
Können Sie mir weiterhelfen?
A: Es geht hier um die so genannte Silberung von Wasser. Dabei bildet sich neben
Silber-Ionen kolloidales Silber (Silbersol). Die Mischung nennt man auch Silberwasser. Sie wird wegen
der bakteriziden Wirkung von Silber-Ionen immer noch als Hausmittel eingesetzt, das manche Leute nicht nur zum Wasserdesinfizieren
verwenden, sondern auch für medizinische Zwecke inkorporieren. Wegen der Nebenwirkungen von Silber(-Ionen) auf unseren Organismus
ist das Verfahren nicht unumstritten.
Die Herstellung kann auf verschiedenem Wege ablaufen. Am bekanntesten ist die Elektrolyse.
Hierzu werden zwei Reinsilberelektroden in destilliertes Wasser gehängt. Wenn man Gleichstrom anlegt, läuft das gleiche ab wie
zum Beispiel bei der Raffination von Kupfer.
Anode (Oxidation): Ag —> Ag+ + e-
Kathode (Reduktion): Ag+ + e- —> Ag
Die Anode würde sich zersetzen, die Kathode würde wachsen.
Bei der Silberung legt man an die Elektroden eine nicht zu hochfrequente Rechteckwechselspannung an. Dann bildet sich das gewünschte
Silberwasser. Die Spannung muss relativ hoch sein, wenn man eine vernünftige Ausbeute erzielen will, weil demineralisiertes Wasser
den elektrischen Strom kaum leitet. Man arbeitet je nach gewünschter Konzentration mit Spannungen zwischen 2 und 50 V.
Die Herstellung dauert wegen der geringen Leitfähigkeit des Wassers allerdings lange - man muss schon einige Stunden elektrolysieren,
um zu einem mengenmäßig vernünftigen Ergebnis zu kommen.
Wie kommt es überhaupt zur Bildung von Silbersol?
Man muss wissen, dass die elektrolytische Metallabscheidung auf der Kathoden-Oberfläche nicht zur sofortigen Ausbildung von
hochgeordneten Kristallgittern führt, sondern zunächst zur Ausbildung von amorphen Silberatom-Schichten. (Das ist übrigens bei
allen Kristallisationsprozessen der Fall - so auch bei Feuerstein und Quarz (Vorstufe Kieselgel!),
Eis, Calcit usw.)
Wird die derart mit amorphen Silber belegte Kathode durch die Wechselspannung zur Anode umgepolt, so bilden sich plötzlich statt der Silberatome „schwimmfähige“ Silber-Ionen, die dazu noch von der Gegenelektrode angezogen werden. Deshalb drücken sie das gerade gebildete amorphe Silber in das Umgebungswasser und verteilen die Kolloide weiträumig.
Man muss noch an die Elektrolyse von Wasser denken, die zur Freisetzung von Wasserstoff und Sauerstoff führt. Deshalb sind in gesilbertem Wasser neben Silbersol und Silber-Ionen natürlich auch amorphe Silberverbindungen wie Silberoxid oder -hydroxid enthalten.
Sehen kann man diese Kolloide nicht. Nachweisen kann man die Bildung der Kolloide in der Schule nur durch die optische Tyndall-Probe.
1742
F: Ich habe mit großem Vergnügen in den merkwürdigen Emails auf ihren Webseiten geblättert
und schicke mich an, die Kuriositätensammlung zu erweitern. Auf Ihre Seiten stieß ich zufällig, als ich begann, mich zum Thema
"Eloxierung entfärben" über Google einzulesen. Konkret habe ich einen Laufradsatz für ein Fahrrad, der schwarz eloxiert ist,
den ich aber lieber farblos hätte.
Meine eigentliche Frage ist nun, ob es möglich ist, eloxierte Aluminiumoberflächen zu bleichen/ zu entfärben und wenn ja, womit.
Schön wäre wenn dabei weder das Aluminium der Bremsflächen, noch das Eloxat beeinträchtigt würden. Ich bin nicht mit Wissen zum
Thema Chemie belastet, um die von Ihnen gelegentlich angemahnte Vorstellung zu erweitern, mir wären sowohl aufwändige Aufbauten
als auch die Beschaffung schwer zu erwerbender Chemikalien nicht möglich.
Sollte es keine mit Haushaltsmitteln oder Apothekenhilfe zu erledigenden Wege geben, bedanke ich mich gleichwohl im Voraus für Ihre Mühe und Zeit, diese Nachricht gelesen zu haben und verbleibe mit fröhlichen Grüssen, (…)
A: Ihre Frage ist nicht lächerlich, sondern interessant - sicherlich auch für andere Leute.
Die Eloxalschicht besteht vor allem aus Aluminiumoxid. Das hat hohe adsorptive Eigenschaften, was man sich
bei der Einfärbung zunutze macht. Es ist klar, dass man dazu besonders gut haftende Farben verwendet. Sie herauszulösen, wird Ihnen
nicht gelingen. Wenn Sie mit irgendwelchen Lösemitteln rangehen, wird Ihr Laufsatz höchstens scheckig aussehen.
Sie können die Schicht natürlich auch abbeizen. Das ginge mit Natronlauge. Aber auch davor ist zu warnen: Die Eloxalschicht hat
vor allem die Aufgabe, das Aluminium vor weiterer Korrosion zu schützen („Passivierung“). Nimmt man diese Schicht herunter, oder
verletzt man sie, so beginnt die Korrosion besonders rasch einzusetzen. Natronlauge fördert sogar die Korrosion
von Aluminium.
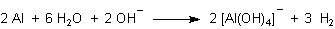
Das Gesagte gilt übrigens auch für Titan.
1743
F: Wir haben in der Schule gelernt, dass alle Stoffe, die H-plus-Ionen abgegeben, Säuren nach
Brönsted sind. Ist demnach CH4 eine Säure, wenn es ein solches Ion abgibt, soweit dieses möglich ist?
A: Grundsätzlich stimmt die Definition der Brönsted-Säure als Protonen-Donator. Allerdings
ist CH4 (Methan) in dieser Hinsicht ein toter Hund, das heißt, es wird auch unter groben Bedingungen kein Proton
abgeben. Anders gesagt: Es gibt keine Base, die dem Methan ein Proton entreißen könnte. Das ist auch in anderen Lösemitteln als Wasser
nicht möglich. Deshalb ist es keine Brönsted-Säure.
Für Interessierte: Es gibt aber durchaus organische Verbindungen, bei denen die Bindung zwischen C und H unter Bildung von H+-Ionen gelöst werden kann. Das sind solche Verbindungen, bei denen aufgrund der Nachbarschaft von Gruppen mit (-I)-Effekt ein starker Elektronenzug von der C-H-Bindung weg besteht. Man spricht von CH-aciden Verbindungen. Sie enthalten meistens eine aktive Methylengruppe.
Ein bekanntes Beispiel ist der Malonsäure-diethylester (Malonester), von dem es sogar Natrium-Salze zu kaufen gibt. Die sind allerdings nur in nichtwässrigen Lösemitteln stabil.
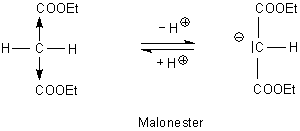
Der Malonester spielt eine wichtige Rolle in der organisch-chemischen Synthese - zum Beispiel zur Herstellung von Zimtsäure.
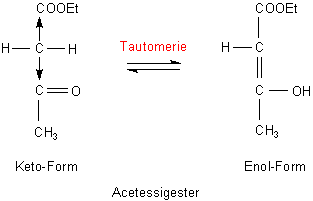
Das gilt auch für den Acetessigsäureethylester, kurz Acetessigester. Der verfügt ebenfalls über eine C-H-acide Methylengruppe. Typisch für den Acetessigester ist das Keto-Enol-Gleichgewicht (Tautomerie).
1744
F: In letzter Zeit wird wegen der mexikanischen Grippe über das Grippemittel Tamiflu® gesprochen.
Was ist das? Wie wirkt es?
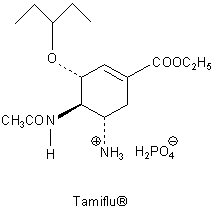
A: Tamiflu® heißt auch (-)-Oseltamivir-phosphat. Dies ist die Strukturformel.
Um die Wirkung dieses Präparats zu verstehen, muss man etwas über die Viren wissen. Viren verfügen über eine begrenzte Anzahl von Genen, die einige wenige Proteine codieren. Das betrifft nicht nur der Syntheseapparat für die Hüllproteine, sondern es sind auch Enzyme, die es dem Virus erlauben, die Zellwand des Wirts zu erkennen und auch zu durchdringen.
In der Zellwand gibt es die Glykoproteine, die als Nichtaminosäure-Gruppe (prosthetische Gruppe) ein Polysaccharid tragen, das u. a. aus N-Acetyl-Glucosamin, N-Acetyl-Desoxy-galaktose sowie aus einem N-Acetyl-Mannosamin-Derivat, der N-Acetyl-Neuraminsäure (NANA; auch Sialinsäure genannt), besteht. Diese Polysaccharidgruppen spielen u. a. eine wichtige Rolle bei der Zellerkennung, zum Beispiel als Blutgruppensubstanzen.
Hier dockt das Virus an und startet am gleichen Ort auch seinen Angriff. Das Virus verfügt über eine Hydrolase bzw. Glykosidase, die Neuraminidase, das die glykosidische Bindung zwischen der N-Acetyl-Neuraminsäure und den N-Acetylzuckern spaltet. Mit seiner Hilfe schickt das Virus seine Nukleinsäure in die Zelle. Mit Hilfe des gleichen Enzyms können die anschließend neu gebildeten Viren die Wirtszelle auch wieder verlassen.
Das sperrig gebaute Tamiflu® hemmt dieses Enzym.
1745
F: In letzter Zeit gab es Berichte, dass Vanille-Eis keine Vanille enthält. Aber das
schmeckt doch nach Vanille?!
A: Der Aromastoff von Vanille-Eis ist Vanillin. Es ging in erster
Linie darum, dass die Hersteller ihr Eis mit synthetischem Vanillin parfümiert haben, aber ihr Produkt zugleich auf
der Packung mit der Bezeichnung Vanille oder sogar mit Bourbon-Vanille beworben haben. Letztere gibt es nur
auf der Insel La Réunion (früher Ile Bourbon), und nur diese darf so genannt werden. (Weitere Naturvanille kommt z. B.
von Madagaskar.) Genau genommen haben die also kein Vanille-Eis verkauft, sondern Vanillin-Eis.
Aufgespürt haben das analytisch fähige Lebensmittelchemiker: Künstliches Vanille-Aroma ist ziemlich rein und enthält hauptsächlich nur einen Stoff, nämlich Vanillin. Bourbon-Vanille wird durch Fermentierung aus der Vanille-Orchidee gewonnen. Als Naturprodukt hat dieses Vanillin eine Reihe typischer Begleitstoffe, zum Beispiel Vorstufen und Abbauprodukte von Vanillin. Damit zeigt jede natürliche Vanille-Art ein spezifisches Analyse-Muster - das man zum Beispiel bei der Chromatographie (HPLC) oder Massenspektrometrie sieht. Weiter sind Vanillin samt typischer Vanillinbegleitstoffe auch in alkoholischen Getränken enthalten, die lange Zeit in Holzfässern gereift sind - z. B. in edlem Cognac oder Whiskey. Auch hier wird gefälscht und gepanscht.
Zur Vanille und zur technischen Herstellung von Vanillin haben wir eine Webseite.