 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1901
F: Ich bin etwas verwirrt, habe ich mich doch bei unterschiedlichen Quellen informiert
(die Informationen sind generell sehr dünn): Mir ist der Unterschied zwischen dem Kimball-Modell ("Kugelwolkenmodell") und dem
EPA-Modell nicht klar - in dem Lehrplan für die 11. Klasse Biotechnologisches Gymnasium steht beides unter den verbindlichen
Inhalten - also müsste es ja einen Unterschied geben! Können Sie mir weiterhelfen?
A: Zunächst scheinen beide Modelle gleich zu sein. Man spricht von Tetraedermodellen.
Das Kugelwolkenmodell ist ein stark vereinfachtes EPA-Modell, das für schulische Zwecke meistens ausreicht, um räumliche Molekülstrukturen wie das Tetraeder des Methanmoleküls oder die Dipolentstehung beim Wassermolekül zu erklären. Jeweils zwei Elektronen bilden eine Kugelwolke. In den Bindungen sind die Elektronenbahnen, die das Elektronen-Oktett bilden, gleichwertig. Mit diesem Modell kann man meines Wissens nach die flache, trigonale Geometrie von C=C-Doppelbindungen nicht erklären.
Das EPA-Modell hat dagegen quantenmechanische Bezüge, da es die Hybridorbitalbildung aus s-, p- (und auch d- und f-) Atomorbitalen einbezieht. Damit lassen sich auch andere Strukturen als Tetraeder (Methanmolekül) oder Tetraederausschnitte (Wasser- oder Ammoniakmolekül) verstehen.
1902
F: Ich bin Chemielehrer in Ludwigshafen und streite mit einem Elternteil über folgenden Sachverhalt:
Herleitung einer Gleichung zur Bestimmung der Wärmekapazität eines Kalorimeters.
Ansätze:
a) Q1 = Q2
b) Q1 + Q2 = 0 (mit Q2 dann negativ)
Welcher Ansatz ist der bessere?
A: Besser? Wie man es nimmt. Da scheint es Probleme mit einem Berufschemiker zu geben…
Schreiben Sie es am besten so mit Absolutzeichen:
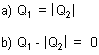
Oder gleich so, um allen Missverständnissen aus dem Wege zu gehen:

1903
F: Hallo, ich schreibe gerade an einer Hausarbeit zum Thema Butter- und Margarineherstellung.
Ich verstehe dabei einfach nicht, warum man bei der Margarineherstellung zu dem erwärmten Kokosfett-Öl-Gemisch kaltes Wasser
dazugeben kann! Und warum es sich nicht wieder trennt, wenn die Margarine abkühlt.
Den Prozess bei der Butterherstellung habe ich verstanden, aber den bei der Margarineherstellung einfach nicht!
A: Die Sache ist einfach: Es bildet sich eine Wasser-in-Öl-Emulsion. Es sind nämlich
feinste Wassertröpfchen im Fett bzw. im Öl eingebettet. Als Emulgatoren kommen in natürlichen, fetten Ölen stets enthaltene
Fettsäuren oder halbwegs hydrolysierte Triglyceride, also Di- oder Monoglyceride, in Frage. Es gibt dazu auch emulgierende
Zusätze wie zum Beispiel Lecithin.
1904
F1: Ich bin beim Thema Molmassenbestimmung von Gasen in einem Schulbuch Chemie auf eine
Ungereimtheit gestoßen. Hier wird für n-Butan eine Dichte von 2,47 g/l, für iso-Butan eine solche von 2,17 g/l immer bei 20°C
angegeben. Daraus sollen Schüler nun die Molmasse des Butans errechnen (Molvolumen 24 l/mol), ebenso aus der Summenformel. Der
Widerspruch -- es handelt sich ja um Isomere -- wird nicht erklärt. Sind wir hier an den Gegensatz ideale/reale Gase gestoßen?
Die Begriffe tauchen hier nicht auf. Die Zahlenwerte können ganz falsch nicht sein, das Tabellenwerk D'ans-Lax führt ähnliche an.
Dann könnte nur noch das "konstante" Molvolumen doch nicht so konstant sein.
A1: Die „wahre“ Molmasse der beiden Isomere beträgt 58 g/mol. Die Berechnung anhand der
Dichte ergäbe für n-Butan eine Molmasse von 2,47 g/l * 24 l/mol = 59,28 g/mol, für i-Butan 2,17 g/l * 24 l/mol = 52,04 g/mol.
Sie haben Recht: Das Avodagro-Molvolumen (22,414 l/mol bei 0 °C bzw. 24,06 l/mol bei 20 °C) gilt genau genommen nur für ideale Gase oder Gase, deren Siedepunkte weit genug von 0 °C bzw. 20 °C entfernt liegen. Der Siedepunkt von n-Butan liegt jedoch bei -0,5 °C, der von Iso-Butan bei -12 °C. Es handelt sich bei den beiden Gasen um ausgesprochen reale Gase.
Je realer das Gas ist, desto kleiner ist sein Molvolumen: Helium 22,42; Luft 22,40; Methan 22,38; Ammoniak 22,00; Propan 21,89 l/mol (bei 0 °C).
Es greift hier die van der Waals-Beziehung, bei der das Eigenvolumen der Gase sowie die gegenseitige Anziehung ihrer Moleküle nicht mehr vernachlässigt werden kann. (Bei den Isomeren geht es vor allem um die Molekülformen. Damit kann man auch den Dichteunterschied der beiden Isomere erklären.)
Mit der Methode der Molmassenbestimmung von Gasen mit Hilfe des Molvolumens erhält man bei Verwendung des idealen Avodagro-Molvolumens nur Näherungswerte, mit denen man aber gut leben kann.
Übrigens gibt es Tabellen, in denen für verschiedene Gase neben der Dichte auch das Molvolumen aufgelistet ist.
Zur Molmassenbestimmung von Gasen haben wir einen Tipp des Monats.
F2: Danke für Ihre Mühe.
In der ganzen Mittelstufe wird den Schülern eingebläut, 22,4 sei das Molvolumen. Dann ohne Kommentar solch ein Überfall, den kein
Schüler einordnen kann. Das ist nicht schlau. Selbst im Oberstufenbuch wird dieses Problem durch Nichterwähnen umgangen. Keiner erwartet
an dieser Stelle Verweise auf die Physikalische-Chemie-Vorlesung.
Nochmals danke
1905
F: Mein Chemielehrer und ich sind am verzweifeln. Ich sollte die Voltasche Säule vorstellen. Das
hat soweit ganz gut geklappt. Dabei haben wir jedoch festgestellt, dass wir eine zu hohe Spannung erhalten (sie liegt bei 0,86 Volt),
wobei ja eigentlich nur 0,76 Volt entstehen sollten. Es würde mich freuen, wenn sie mir helfen könnten, dieses Problem irgendwie zu lösen.
Außerdem wollte mein Chemielehrer eine Zinkplatte reinigen und hat sie in konzentrierte Salzsäure gelegt, als er sie aber wieder herausholte,
war die Platte komplett schwarz. Wissen sie vielleicht, woran das liegen könnte?
A: So richtig verstehe ich Ihre Frage nicht: Eine Voltasäule kann sogar Spannungen von mehreren
Hundert bis Tausend Volt liefern. Die besteht aus vielen in Reihe geschalteten Volta-Elementen. Oder meinen Sie ein einzelnes Volta-Element?
Ob die Spannung wirklich das Standardpotential von Zink (-0,76 V) erreicht, hängt von vielem ab. So bestimmt man die Tabellenwerte der Standardpotentiale (Spannungsreihen) mit Metallen bzw. Nichtmetallen in Lösungen ihrer Salze mit der Aktivität 1 mol/l. Solche Messungen müssen auch ohne Sauerstoffgehalt der Lösungen erfolgen. Seien Sie also nicht erstaunt, wenn Sie gering abweichende Werte erhalten.
Dass Ihr Lehrer Zinkplatten mit konzentrierter HCl reinigt, ist wenig professionell. Die zersetzen sich viel zu schnell. Das Schwarze, was da auftaucht, sind Legierungsbestandteile wie z. B. feinverteiltes Kupfer. Für solche Versuche muss man chemisch reines Zink benutzen. Platten kann man mit verdünnter Säure abreiben. Oder man schaltet sie in stark verdünnter Schwefelsäure als Minuspol. Der sich bildende Wasserstoff zerstört Ablagerungen.