 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1896
F: Wie entsteht radioaktives Iod im Kernreaktor und warum soll man Iodtabletten nehmen?
A: Natürliches Iod (Ordnungszahl 53) besteht zu 100 % aus dem Isotop mit der Molmasse 127.
Es gibt darüber hinaus viele (etwa 20) künstliche Iod-Isotope. Das bekannteste und gefürchtete radioaktive Iod-Isotop hat die Molmasse 131.
Im Kernreaktor entsteht es als Spaltprodukt von Uran oder Plutonium. Es wird vor allem bei Reaktorunfällen freigesetzt - wie jetzt in Japan.
Es zerfällt mit einer Halbwertszeit von 8,02 Tagen unter Abgabe eines Elektrons (Beta(-)-Zerfall) zu Xenon:
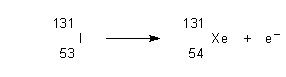
Iod wird als essentielles Spurenelement von der Schilddrüse „eingesammelt“ (Klicke hier). Wenn das eingelagerte Iod radioaktiv ist, wird die Schilddrüse durch dessen Beta-Strahlung geschädigt. Um die Aufnahme von Iod-131 zu verhindern, sättigt man den Speicher der Schilddrüse von vornherein durch Einnahme von Kaliumiodid-Tabletten (nicht ganz exakt „Iodtabletten“ genannt), die nur Iod-127 enthalten.
Aber Achtung: Zuviel Tabletten darf man auch nicht zu sich nehmen (nach dem Motto „Viel hilft viel“), denn auch das ist schädlich.
1897
F1: Nachdem ich bei meinen Recherchen im Internet und Büchern nicht fündig geworden bin (oder
die Erklärung nicht erkannt habe?), wende ich mich mal wieder an Sie.
Bei der Titration einer schwachen Säure (HAc) mit einer starken Base hat man ganz zu Beginn einen verhältnismäßig starken Anstieg
des pH-Wertes, bevor die Kurve in den flacheren Pufferbereich um den pKs-Wert mündet. Wie kann man diesen anfänglichen Anstieg erklären?
Ist das so, da anfangs aufgrund der geringen Protolyse von HAc nur wenige H3O+ vorliegen, die sofort von den
zugegebenen OH- neutralisiert werden und weitere HAc nicht so schnell dissoziiert, so dass es für kurze Zeit zu einem stärkeren
pH-Anstieg kommt? D.h. es würde kurzzeitig nur die Reaktion H3O+ + OH- -> 2 H2O ablaufen?
Dass die Kurve dann abflacht, weil mehr Ac- vorhanden sind und dann auch die Rückreaktion zu HAc vermehrt stattfindet ist dann
wieder verständlich. Hier läuft dann die Reaktion HAc + OH- <--> Ac- + H2O ab? Leider geht das aus
Ihrer Seite (für mich) nicht hervor.
A1: Zunächst einmal sind Titrationskurven halblogarithmische Darstellungen, die unser auf Linear
getrimmtes Denken deutlich erschweren…
Es handelt sich um zwei sich überlappende Gleichgewichtssysteme, H3O+ / H2O und das einer schwachen Säure HAc / Ac-.
Zunächst liegen ganz wenige H3O+-Ionen vor. Denn Essigsäure (HAc) zum Beispiel ist in 0,1-molarer Lösung nur zu 1 Promille dissoziiert. Wenn man da ein paar Tropfen NaOH zugibt, steigt der pH-Wert rasch in Richtung auf pH 10 an - so, als würde man zu Wasser NaOH geben.
Anschließend tritt eine chemische Reaktion ein: Die direkte Reaktion von NaOH mit undissoziierter Essigsäure. (Natürlich kann man auch sagen, dass HAc dissoziiert, und die NaOH reagiert mit den auf diese Weise gebildeten H3O+-Ionen…) Egal: Dabei wird entsprechend viel NaOH verbraucht - die Gleichgewichtskurve mit flachem pH-Wertanstieg resultiert. Das ist die berühmte Pufferkurve.
Wenn alles HAc ausreagiert hat, steigt aufgrund der geringen Konzentration von H3O+ die normale Titrationskurve des Wassers wieder steil an.
Um das praktisch zu zeigen, titrieren Sie Essigsäure (c = 0,1 mol/l, gelöst in verdünnter Salzsäure (0,1 mol/l)), mit NaOH (c = 0,1 mol).
Je stärker die schwache Säure ist, desto niedriger ist auch der Start-pH-Wert, und desto geringer ist auch der Anstieg zu Beginn der Kurve.
Um das praktisch zu zeigen, titrieren Sie (Mono-, Di-…)Chloressigsäure (c = 0,1 mol/l, gelöst in verdünnter Salzsäure (0,1 mol/l)), mit NaOH (c = 0,1 mol).
F2: Vielen Dank für Ihre schnelle Antwort!
Und es ist schön, so eine "Stelle" zu haben, bei der man solche Dinge, die nirgends stehen, nachfragen kann.
Bis zum nächsten Mal (…)
1898
F: In den Zeitungsmeldungen zum japanischen Reaktorunglück wird davon geredet, dass die Japaner
das Löschwasser mit Borsäure anreichern. Warum das?
A: Es geht um das Ausbremsen von unkontrollierbar gewordenen Kettenreaktionen.
Die Hintergründe: Die Funktion eines Kernreaktors beruht auf der durch Neutronen bewirkten Kernspaltung, die bekanntlich als Kettenreaktion abläuft. Ob und wie der Reaktor richtig läuft, hängt von der Größe des Multiplikationsfaktors k ab. Das ist das Verhältnis von gebildeten zu verbrauchten Neutronen.
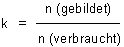
Mit k = 1 läuft der Reaktor moderat.
Mit k < 1 läuft der Reaktor gar nicht erst an oder die Kettenreaktion bricht ab; er ist subkritisch.
Mit k > 1 beginnt lawinenartig eine ungesteuerte Kettenreaktion; der Reaktor ist überkritisch geworden.
Man muss also irgendwie die Anzahl der Neutronen kontrollieren. Das geschieht technisch im Allgemeinen mit aus Cadmium gefertigten Kontrollstäben, die man zwischen die Brennelemente schiebt. Denn Cadmium ist ein starker Neutronenabsorber.
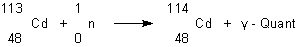
Die gleiche Eigenschaft besitzt auch das Element Bor.
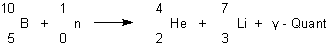
Deshalb fertigt man Kontrollstäbe auch aus Borcarbid oder aus borhaltigem Stahl.
Wenn die Steuerung dieser Maßnahme nicht mehr möglich ist (wie jetzt in Japan), so muss man andere Wege finden, um die Elemente zuführen, die Neutronen absorbieren und so als Reaktorgifte wirken. Bor gibt man in der Form von Borsäure zum Kühlwasser und hofft so, den Multiplikationsfaktor Richtung 1 oder < 1 zu steuern.
1899
F: Mir ist nicht ganz klar, warum Kunststoffreiniger Ammoniak enthalten. Haben Sie eine Antwort
auf die Frage?
Ich bedanke mich bereits jetzt schon für Ihre Mühe und auch für Ihre immer sehr interessante und hilfreiche Webseite. Aus ihr habe ich schon viele gute Ideen entnommen.
A: Oberflächenreiniger sollen u. a. Fette entfernen. Dazu müssen sie alkalisch eingestellt sein,
denn durch Laugen können Fette und fette Öle hydrolysiert (gespalten) werden.
Anders als Natronlauge oder Soda sorgt Ammoniak rückstandsfrei für alkalisches Milieu, da es beim Eintrocknen abdampft.
Aus diesem Grunde findet man es auch in Fensterputzmitteln.
1900
F: Ich suche nach möglichen Nachweisen für Ammonium-Kationen in Düngemitteln.
Der Klassiker ist sicherlich der Nachweis über die Bildung von Ammoniak mit NaOH.
Funktioniert das Erhitzen und Bildung von Ammoniak?
Eine weitere Möglichkeit ist mit Nesslers-Reagenz. Ist in der Schule sicherlich nicht durchführbar!
Auch lässt sich Ammonium mithilfe von Teststäbchen nachweisen. Beruht die Reaktion bei den Teststäbchen immer auf Grundlage der
Nessler Reagenz oder gibt es auch andere Teststäbchen?
Haben Sie evtl. noch andere Nachweise für Ammonium-Kationen?
Ist die Gleichung für Nessler richtig?
2 [HgI4]2-(aq) + NH4+(aq) + 4 OH-(aq) ——> [Hg2N]I(s) + 4 H20(l) + 7 I-(aq)
A: Der Ammoniumnachweis mit NaOH ist nur dann positiv, wenn Sie die
Reaktionsmischung nicht erwärmen. Sonst erfassen Sie auch gebundenes Ammonium wie Harnstoff. Zu dessen alkalischer
Hydrolyse müssen Sie erwärmen. Beispiel: Dünger wie HaKaPhos.
Man kann aber auch Ammoniak abdestillieren und in einer Vorlage auffangen, um es dann mit HCl gegen Phenolphthalein zu titrieren. Aber dabei erfasst man wie gesagt auch Harnstoff.
Nesslers Reagenz ist wegen der Abfallproblematik nicht mehr erlaubt. Es ist sowieso den Schülern nicht zu vermitteln, dass man - um umweltschädliche Substanzen (hier: zuviel Ammonium) nachzuweisen - ausgerechnet extrem umweltschädigende Substanzen nutzt…
Ihre Reaktionsgleichung von Nesslers Reagenz ist richtig, aber ich würde sie abgespeckter, also einfacher so schreiben:
2 K2[HgI4] + NH3 ———> [Hg2N]+ I- + 4 KI + 3 HI
Es gibt noch weitere Methoden zur Bestimmung von Ammonium. Die Sticks sind mir bekannt, aber ich weiß nicht, was chemisch dahinter steckt. Vielleicht das:
Die Indophenolmethode. Prinzip: Ammonium-Ionen reagieren mit chlor-freisetzenden Reagenzien zu Chloramin, das mit Salicylsäure blaues Indophenol gibt, welches fotometrisch bestimmt wird.
Zu den Ammoniumnachweis-Verfahren haben wir übrigens eine Webseite.