Prof. Blumes Tipp des Monats November 2003 (Tipp-Nr. 77)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Zusatzstoffe im Speisesalz:
Warum jodiert man Speisesalz mit Kaliumiodat?
Gleich vorneweg: Wenn Sie nach den zu diesem Thema passenden Stichworten suchen, beachten Sie bitte: Iod, Iodid und Iodat schreibt man in der Wissenschaft heute mit einem "i". Dagegen ist in der allgemein zugänglichen Literatur das "j" gebräuchlich: Jodieren, Jodierung... Wir versuchen es im folgenden Text mit einer Mischung aus beiden Schreibweisen.
Immer wieder wird gefragt: Warum muss man Speisesalz überhaupt jodieren, also Iod zusetzen? Warum setzt man zum Jodieren von Speisesalz nicht Iodid, sondern Iodat zu? Und ist Iodat nicht gefährlich?
Warum wird Speisesalz überhaupt jodiert?
Der Körper braucht das Iodid. Iod ist ein wichtiges
Spurenelement. An der Formel der Schilddrüsenhormone Thyroxin und
Triiodthyronin erkennt man, warum.
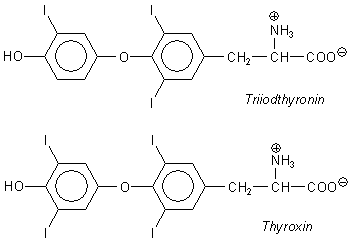
Schilddrüsenhormone haben bei sehr vielen zentralen Körperfunktionen "mitzureden".
Pro Tag benötigt der erwachsene Mensch 100 Mikrogramm Jod. Leider sind die Böden und Gewässer unseres Landes äußerst arm an Iodid. Dieses Salz ist nämlich sehr gut löslich. Es wurde deshalb in den Zeiten der ausklingenden Eiszeiten einfach durch die Schmelzwasser der Gletscher aus den Böden herausgelöst und ins Meer gespült. Meere sind bekanntlich immer noch unsere Hauptquelle für Iod: Jeder weiß, dass in Meeresfrüchten und in Algen sehr viel Iod vorhanden ist, so dass man mit einer guten Fischmahlzeit seinen Iodbedarf für einige Tage decken kann. Übrigens wurde Iod 1811 vom Salpetersieder Bernard Courtois in der Asche von Algen entdeckt.

Bild 1: Fischauslage auf einem bretonischen Fischmarkt
(Foto: Daggi)
In welcher Form liegt das Iod im jodierten Speisesalz vor?
Jeder denkt sofort an Natrium- oder Kalium-Iodid. Das ist aber mit den schulüblichen Methoden neben
dem vorherrschenden Chlorid schwer nachzuweisen, liegt es im Speisesalz doch nur in einer Konzentration
von ca. 0,005 Masse% vor. (Das sind 50 g/t Salz oder 50 mg/kg.) Schließlich ist Iod ein Spurenelement,
das dazu noch bei zu hoher Konzentration die Schilddrüse schädigt.
Es gibt aber auch eine andere Form, Iod einzubringen, nämlich als Iodat. Für Iodat kennt die Chemie
es einen schönen Nachweis. Der beruht darauf, dass in saurer Lösung Iodat mit Iodid zu Iod reagiert (sog.
Symproportionierungs- oder auch Komproportionierungsreaktion).
Hinweis zu den Versuchen
Wir verwenden für unsere Versuche das oben abgebildete Bad Reichenhaller Jodsalz.
Zu der schlechten Löslichkeit des Speisesalzes und zu der Trübung seiner Lösung sagen wir unten etwas.
Aber es sei gleich vorneweg gesagt: Mit leichtem Ansäuern lässt sich das Problem (fast immer) beseitigen.
|
Versuch 1: Qualitativer Nachweis von Iodat in jodiertem Speisesalz
|
Zwischen den Iodchemikalien spielt sich eine Redoxreaktion ab:
IO3- + 5 I- + 6 H+ ———> 3 I2 + 3 H2O
(Mit Iodat titriert man zum Beispiel den Gehalt von Ascorbinsäure. Die Reaktion in Versuch 1 nutzt man dabei zur Erkennung des Endes der Titration.)

Bild 2: Iodatnachweis ohne (links) und mit (rechts) Stärkelösung
(Foto: Daggi)
Kann man das Vorliegen von Iodat im Speisesalz quantitativ nachweisen?
Spezialisten können den Gehalt an Iodat mit entsprechenden Apparaten (zum Beispiel zur
Ionenchromatographie) schnell ermitteln. Es gibt auch die einfachere Möglichkeit der
volumetrischen Titration (Maßanalyse) von Iodat. Dazu nutzt
man die Reaktion, die wir in Versuch 1 gezeigt haben. In der Schule gelingt die Titration
allerdings kaum ohne großen Fehler, da der Iodat-Anteil im Speisesalz
nur 0,0025 Masse-% beträgt und der Endpunkt einer Iod-Titration nur sehr schwer zu erkennen
ist. Es ist dazu viel Erfahrung nötig.
Warum jodiert man mit Iodat?
Die erste Überlegung eines Chemikers ist: Iodid muss durch den Magen wandern, und der enthält
Salzsäure. Damit kann man sogar einen großen Eisennagel zersetzen! Jeder Chemiker weiß: In Säuren
ist Iodid nicht stabil. Prüfen wir das einmal nach.
|
Versuch 2: Kalium-Iodid reagiert mit Säuren
|

Bild 3: Ergebnisse der Behandlung von festem Kalium-Iodid mit Säuren.
Von links nach rechts: Konzentrierte Schwefelsäure, Schwefelsäure (c = 2 mol/l) und Salzsäure (c =
1 mol/l)
(Foto: Daggi)
In allen Fällen entwickelt sich beim Ansäuern elementares Iod. Man erkennt das an der zunächst gelben, dann braunen Farbe. Setzt man zum Ansäuern konzentrierte Schwefelsäure ein, so beobachtet man sogar violetten Ioddampf. Denn je stärker die Säure ist, desto heftiger ist die Reaktion der Iodfreisetzung. (Auf diese Art entdeckte auch Courtois das Iod bei der Untersuchung der Algenasche.)
Wir wiederholen den Versuch mit Kaliumiodat
|
Versuch 3: Kaliumiodat reagiert nicht mit Säuren
|
Es findet keine Reaktion statt. Wir sehen also, dass Iodat stabiler ist als Iodid. Iodat ist auch nicht weiter giftig. (Außerdem ist es ja nur in äußerst geringen Mengen vorhanden.) Es wird im Darm sofort zu Iodid reduziert und ist dann bereit, ins Blut und anschließend in die Schilddrüse geschleust zu werden.
Für Spezialisten: Warum eigentlich ist Iodid gegenüber Säuren instabil?
Nicht nur im Schullabor stellt man kleinere Mengen an Chlorwasserstoff HCl aus
Kochsalz her, indem man es mit konzentrierter Schwefelsäure übergießt.
Chlorwasserstoff entweicht als farbloses, stabiles Gas.
2 NaCl + H2SO4 ———> 2 HCI + Na2SO4
Beim Iodid ist das etwas anders: Zunächst wird zwar auch hier farbloser, gasförmiger Iodwasserstoff HI freigesetzt.
2 KI + H2SO4 ———> 2 HI + K2SO4
Die Verbindung HI ist im Gegensatz zu HCl jedoch nicht stabil. Sie zerfällt rasch in Wasserstoff und Iod:
2 HI ———> H2 + I2
Iodid ist vor allem instabil gegenüber Umwelteinflüssen
Speisesalz enthält so wenig Iodid, dass eine etwaige Iodbildung durch Säureeinwirkung für den
Körper nicht weiter gefährlich ist. Außerdem liegt die Salzsäure im Magen ziemlich verdünnt vor:
Ihre Konzentration beträgt nur etwa 0,1 Mol/Liter. Die Salzsäure ist darüber hinaus noch durch
Milchsäure abgepuffert, so dass sich die Iodfreisetzung aus Iodid in Grenzen hält.
Ein wichtiger Grund für das Jodieren mit Iodat ist aber auch noch ein anderer Aspekt: Iodid ist instabil gegen Sauerstoff und Lichteinwirkung (genau: gegen UV-Bestrahlung). Wenn dazu noch Feuchtigkeit kommt, wird Iodid rasch in Iod umgewandelt. Dieses sublimiert leicht ab, so dass mit Iodid jodiertes Speisesalz nicht dauerhaft haltbar ist. Die geringe Haltbarkeit von festem Kalium-Iodid und von Iodidlösungen kennt jeder Chemielehrer, der schon einmal versucht hat, solche Lösungen aufzubewahren. In einem entsprechenden Langzeitversuch kann man diese Instabilität von Iodid den Schülern demonstrieren.
|
Versuch 4: Zersetzung von Kalium-Iodid
|
Leider erweist sich aber auch mit Iodat iodiertes Salz nicht immer als stabil. Auf jeden Fall kommt es vor, dass man ein Gelbwerden des Kochsalzes beobachtet, wenn es länger in der Küche steht (siehe folgendes Bild). Iodat kann einmal mit weiteren Zusatzstoffen von Salz (siehe unten) reagieren, vor allem, wenn es feucht ist. Vielleicht sind es aber auch die Inhaltsstoffe des Küchendunsts. Man spricht von VOCs (Versatile Organic Compounds, flüchtige organisch-chemische Verbindungen). Wenn man derartiges, gelb gewordenes Salz in einen geschlossenes Glas füllt und nach einiger Zeit am Salz schnuppert, stellt man fest, dass es chlorartig riecht – Iod ist schließlich ein Halogen.

Bild 4: Zersetztes Iodsalz (rechts)
(Foto: Blume)
Weitere Zusätze zum Speisesalz
Beim Lösen des Speisesalzes haben wir eine Trübung beobachtet. Diese beruht auf schwerlöslichen
Zusätzen wie Calcium- und Magnesiumcarbonat, die in Konzentrationen von 0,25 bis 2 % die Rieselfähigkeit
des Salzes erhöhen. (Durch Zusatz von Säure zersetzen sich diese Carbonate; -> Versuch 1.) Da Calcium-
und Magnesium-Ionen wichtig für den menschlichen Stoffwechsel sind, bedeutet das sogar noch eine
Wertsteigerung für unsere Gesundheit. Sollte sich bei Säurezusatz die Trübung nicht auflösen, so
handelt es sich um zugesetztes Calciumsilikat oder nur um Kieselsäure. Auch im Meersalz bleiben
ganz besonders viele schwerlösliche Rückstände zurück, z. B. auch Gips.
Die Carbonate und Silicate sind der Grund dafür, dass Lösungen von Speisesalz (auch das aus dem Meer gewonnene) eine alkalische Reaktion zeigen. Das von uns genutzte Salz hat zum Beispiel bei 1prozentiger Lösung einen pH-Wert von 9,9!
Hierauf beruht auch der bekannte Effekt, dass man mit Speisesalz frische Rotweinflecken entfärben kann: Es findet zwar zunächst ein physikalischer Vorgang statt, die Adsorption an Kalk. Jedoch führt die Feuchtigkeit des Rotweins zur Protolyse des Kalksteins und zu alkalischer Reaktion.
CaCO3 + H2O ———> Ca2+ + HCO3- + OH-
In alkalischem Milieu wird ein Großteil der adsorbierten Rotweinfarbstoffe gelb gefärbt (chemische Reaktion). Das kennen wir vom Rotkohlsaft, der im alkalischen Milieu erst grün, dann gelb wird. Der Reinigungseffekt ist, dass die Farbe Gelb anders als Rot keinen besonders hohen Signalcharakter hat und deshalb auch in hoher Konzentration auf uns eher farblos wirkt.
Die Rieselfähigkeit des Salzes wird ebenfalls durch Zusatz von Gelbem Blutlaugensalz, chemisch Kaliumhexacyanoferrat(II), erhöht. Diese Substanz mit der Formel K4[Fe(CN)6] ist trotz der Häufung von Cyanid-Ionen aufgrund ihrer Stabilität völlig ungiftig. Außerdem ist die Konzentration im Speisesalz äußerst gering: 20 ppm (part per million; 20 Massenanteile auf 1 Million). Der Zusatz beeinflusst bereits im Verlauf der Herstellung von Kochsalz dessen Kristallisation. Es bilden sich nämlich ähnlich wie bei den Schneesternen an Kanten und Ecken spitze Kristallauswüchse (Dendriten), die das Zusammenbacken der Kristalle verhindern. Gelbes Blutlaugensalz kann man mit der bekannten Berliner Blau-Probe nachweisen.
|
Versuch 5: Nachweis von Kaliumhexacyanoferrat(II) im Speisesalz
|
Man erkennt in der Speisesalzprobe eine schwache, aber deutliche Blaugrünfärbung. Die wird besonders deutlich, wenn man von oben in die Gläschen hineinblickt.

Bild 5: Wasser (links) und Speisesalzlösung (rechts) mit Eisen(III)-nitrat
(Foto: Daggi)
Zum Schluss
Jodiertes Speisesalz ist nur für eine Gruppe Menschen mit Vorsicht zu genießen: Das
sind diejenigen, die unter einer Überfunktion der Schilddrüse leiden und daher darauf
achten müssen, dass sie nicht zu viel Iod aufnehmen. Lies hierzu die
Webseite.
Rüdiger Blume
Diese Seite ist Teil eines großen Webseitenangebots mit weiteren Texten und Experimentiervorschriften auf Prof. Blumes Bildungsserver für Chemie.
Letzte Überarbeitung: 27. März 2011, Dagmar Wiechoczek