 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
1986
F: Im Chemieunterricht in der gymnasialen Oberstufe bin ich mit meinem Kurs
bei der Behandlung des Daniell-Elements auf folgende Frage gestoßen:
Wie funktioniert der Ladungsausgleich im Daniell-Element?
In unserem Schulbuch (Klett, Chemie-Elemente, Kursstufe, 1. Auflage, Stuttgart 2010, S. 233) wandern sowohl die Zink-Ionen als auch die Sulfat-Ionen durch das Diaphragma. Dies würde letztlich zu einer Vermischung der beiden Lösungen führen.
Im Lehrbuch aus meiner Studienzeit (Riedel, Anorganische Chemie, 3. Auflage, Berlin 1994, S. 343) steht dagegen, dass nur die Sulfat-Ionen durch das Diaphragma wandern. Anscheinend steht dieses auch noch so in der aktuellen Auflage von 2011, diese habe ich aber nicht selbst geprüft.
Was ist nun richtig? Oder stimmt in Abhängigkeit vom Diaphragma so gar beides?
Wenn die Riedel-Version stimmt, habe ich noch eine Zusatzfrage: Wie erreicht man es, dass das Diaphragma ionenselektiv ist? Warum können die positiven Zink-Ionen (die ja wahrscheinlich kleiner sind) nicht hindurch, während die Sulfat-Ionen (die wahrscheinlich größer sind) durchgelassen werden.
A: Beide Versionen sind letztlich mehr oder weniger richtig. Besser ist aber
die Beschreibung von Riedel.
Die Strom liefernde Reaktion ist bekanntlich:
Cu2+ + Zn ———> Cu + Zn2+
Hier ist die Zeichnung zum Daniell-Element
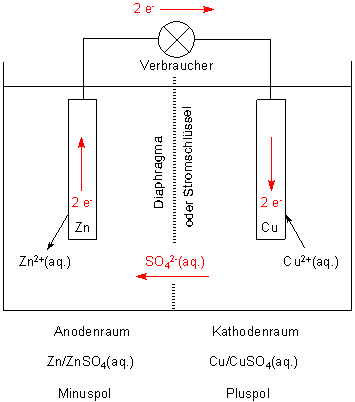
An der Anode (Zink) gehen positiv geladene Zn-Ionen in Lösung. Die Elektronen wandern zum Pluspol (mit dem Metall der höheren EN), also an die Kathode (Kupfer). An der entladen sich nun positiv geladene Cu-Ionen.
Im Anoden-Raum sind nun zu viele Zink-Ionen, im Kathoden-Raum zu wenige Kupfer-Ionen. Der Ladungsausgleich erfolgt durch die Sulfat-Ionen, die in den Zink-Ionen-Raum fließen.
Insgesamt erfolgt bei Stromschluss ein lawinenartiger Kreisverkehr von negativen Ladungsträgern.
Natürlich werden ein paar Zink-Ionen in den Kathodenraum wandern. Dafür sorgen die negative Aufladung der Cu-Elektrode durch einwandernde Elektronen sowie Diffusionsprozesse. Aber diese Wanderung wird erschwert durch den beträchtlichen Gegenstrom an Sulfat-Ionen. Man muss sich da ein ziemliches Gedrängel vorstellen - vor allem, weil die Ionen ja noch mit einer voluminösen Hydrat-Hülle umgeben sind, die sie mitschleppen müssen. Zink-Ionen sind im Kathodenraum deshalb eher die Ausnahme. Hinzu kommt, dass die Cu-Elektrode mit einem blockierenden Pelz von auf die Entladung „wartenden“ Cu-Ionen umgeben ist.
Eine Entladung der Zink-Ionen ist deshalb auszuschließen. Außerdem wird wegen des negativen Standardpotentials des Zinks die Entladungsspannung nicht erreicht.
Es gibt spezielle kationen- und anionenselektive Membranen. Klicke zum Beispiel hier.
1987
F: Im Chemie-Unterricht habe ich die unterschiedlichen Farben des Patentblaus bei verschiedenen
pH-Werten besprochen. Als Schülerversuch vorneweg haben wir mit reinem Lebensmittelfarbstoff und dann mit dem Likör Blue Curacao experimentiert.
Wie erwartet hat der reine Lebensmittelfarbstoff im Sauren eine gelbe Farbe gezeigt, im Neutralen bis schwach Basischen blau und im stark
Basischen farblos. Der Blue Curacao allerdings ist im stark Basischen rot geworden, nicht aber farblos. Wir haben den Versuch mehrmals wiederholt,
es gab immer das gleiche Ergebnis. Hat es vielleicht mit einer Wechselwirkung zwischen Farbstoff und den weiteren Inhaltsstoffen des Likörs zu tun?
A: Bei solchen Gemischen ist es immer schwierig, die gegenseitige Beeinflussung der Substanzen zu
beurteilen. Hinzu kommt, dass auch der hohe Alkoholgehalt eine wichtige Rolle bei der Protonierung spielt. Außerdem kann in dem Getränk eine weitere
Substanz enthalten sein, die im alkalischen Milieu rot wird. Es besteht auch noch die Möglichkeit, dass es sich bei dem blauen Farbstoff gar nicht
um Patentblau handelt.
1988
F: Ich habe eine Frage bezüglich der Polymerisation und hoffe Sie können mir helfen. Woher weiß ich welche
Art von ionischer Polymerisation stattfindet, wenn ich z. B. ein Salz dazugebe? Theoretisch hätte ich ja dann sowohl Anionen als auch Kationen. Oder
funktioniert dann gar keine Polymerisation, weil man bestimmte Stoffe als Initiatoren braucht?
Ich wäre Ihnen wirklich sehr dankbar, wenn Sie mir hier weiterhelfen könnten, da ich am Dienstag eine Leistungskursklausur darüber schreibe. Das System der beiden Polymerisationen habe ich verstanden.
A: Welcher Polymerisationstyp stattfindet, ist tatsächlich eine Frage
der Verbindungen, die man als Katalysatoren zusetzt.
Kationische Polymerisationen werden von Lewis-Säuren wie BF3, AlCl3, TiCl4 oder SnCl4 eingeleitet. Diese reagieren aber nur in Gegenwart von Säuren oder wenigstens etwas Wasser. Dabei bilden sich anionische Komplexe, die zusammen mit den Protonen der Säure/des Wassers die Polymerisation einleiten.
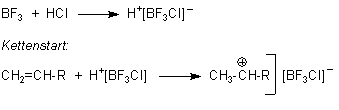
Anionische Polymerisationen werden durch basische Katalysatoren gestartet. Beispiele sind Natriumamid NaNH2, NaOH oder Alkoholate NaOR.
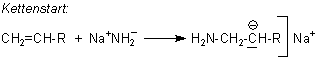
Viel Erfolg bei der Klausur!
1989
F: Ich wollte Quarz in Glas fassen. Dabei musste ich das Glas schmelzen und den Quarz mit erhitzen. Er
zerfiel dabei zu Pulver. Wie kann das sein? Ich dachte, dass Quarz beim Erhitzen schmilzt.
A: Quarz in der Form von Bergkristallen
ist bei Temperaturen unter 100 °C hydrothermal entstanden und enthält deshalb Einschlüsse (Inklusionen) von Luft oder Wasser. Wenn der Stein erhitzt
wird, verdampft das eingeschlossene Wasser. Der gebildete Wasserdampf dehnt sich ebenso wie die eingeschlossene Luft aus und sprengt den kristallinen Stein.
Gleiches erleben Sie, wenn Sie Feuerstein erhitzen. Der ist zwar nicht hydrothermal entstanden, besteht aber auch aus Quarz mit vielen Wassereinlagerungen.
Quarzpulver kann bei stärkerem Erhitzen natürlich schmelzen. Dazu benötigt man aber eine wesentlich höhere Temperatur (genau 1705 °C) als bei Glas, das auch nicht schmilzt, sondern einen Erweichungsbereich zeigt. Beim Abkühlen der Quarzschmelze bilden sich die Bergkristalle nicht zurück, sondern es gibt nur amorphes Quarzglas.
1990
F: Ihre Webseiten sind sehr informativ! Ich habe schon so manchen Ihrer Versuche selbst ausprobiert.
Danke!
Hier meine Frage: Im Kosmos-Anleitungsheft C3000 (V67) wird trockenes Zink vor nassem Zinkpulver erhitzt und damit Wasserstoff
produziert. Einen ähnlichen, baugleichen Versuch (Magnesium statt Zink) habe ich bei Ihnen gefunden.
Kann ich das nasse Zinkpulver durch den nassen Sand, wie es Ihre Anleitung empfiehlt, ersetzen?
A: Sie meinen diesen Versuch. Es spricht nichts
dagegen. Sie können es ja mal versuchen.