 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
2116
F: Wir haben mit einem Ascorbinsäure-Teststäbchen den Saft einer Clementine untersucht.
Der Stick färbte sich blau, und auf einer Farbskala bzw. Tabelle haben wir abgelesen, dass in der Probe 200 mg Ascorbinsäure
enthalten sind. Nun streiten meine Frau und ich darüber, ob sich die 200 mg in der ganzen Clementine befinden, oder nur in der
untersuchten Probe. Wer hat Recht?
A: Keiner hat Recht. Wenn Sie genau hinsehen, steht dort: 200 mg/l Ascorbinsäure. Das kleine
„l“ steht für Liter. Die Angabe ist für Laien verwirrend. Schließlich haben sie ja keinen Liter Ascorbinsäure untersucht. Die Abkürzung
mg/l heißt: In einem Liter des untersuchten Clementinensafts wären 200 mg Ascorbinsäure enthalten - auch wenn es bei der Messung nur
ein Tropfen davon war. Es handelt sich um eine verallgemeinerte Konzentrationsangabe, die unabhängig von der Menge der gerade
untersuchten Lösung ist.
Wenn Sie also einen Liter von dem untersuchten Saft trinken, nehmen Sie 200 mg Ascorbinsäure auf - übrigens in etwa die dreifache
notwendige Tagesdosis (70 mg). Um die Tagesdosis aufzunehmen, müssen Sie nur einen Drittelliter Clementinensaft trinken.
In den Stäbchen ist übrigens Ammonium(VI)-molybdat enthalten. Das wird durch Ascorbinsäure zu einer blauen Molybdän(V)-Verbindung reduziert.
2117
F: Eine kleine Denksportaufgabe habe ich, die ich nicht lösen kann und hoffe auf Ihre Antwort:
Die Angaben, wie viel Bequerel Caesium (137, 136 und 134) durch den Reaktorunfall in Tschernobyl insgesamt über Europa verteilt wurden,
belaufen sich nach Wikipedia auf (summiert) 1,68 • 1017.
Wenn man gleichsetzt, dass ein Bequerel einen Caesiumatom-Zerfall entspricht, wären dies also 1,68 • 1017 Atome. Setzt man dies in Relation
mit der Loschmidtschen Zahl (6,023 • 1023) kommt man auf eine sehr geringe Molmenge von 0,0000002789 Mol. Das wären ja irgendwie nur Bruchteile
von einem Milligramm insgesamt.
Kann meine Rechnung stimmen? Ich denke: NEIN. Aber wo liegt mein Fehler?
A: Für einen Biochemiker wie mich ist nichts einfacher als das!
Das SI-Maß für die Aktivität wird Bequerel (Bq) genannt. Ein Bq entspricht einem radioaktiven Zerfall pro Sekunde; daher die Dimension sec-1. Die summierte Aktivität ist somit ein der Masse analoges Maß für die Freisetzung eines radioaktiven Elements.
Die Aktivität A der gegebenen Menge eines radioaktiven Elements ermittelt man mit folgender Gleichung:
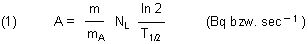
m = Menge des radioaktiven Elements (g)
mA = Atommasse (g/mol)
NL = 6 • 1023 mol-1
T1/2 = Halbwertszeit (sec)
Zur Berechnung die Menge m eines radioaktiven Elements, das die Aktivität A zeigt, wird die Gleichung (1) umgestellt.
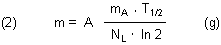
Es folgt eine Modellrechnung. Vereinfachend wird Folgendes angenommen: Das die oben angegebene Aktivität A besitzende Material besteht nur aus Cs-137 (T1/2 = 30,23 a bzw. 9,53 • 108 sec).
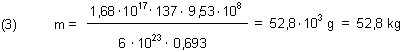
Theoretisch wurden also 52,8 kg Cs-137 freigesetzt. Das ist übertragen auf die Masse des spaltfähigen Materials eines Kernreaktors eine nachvollziehbare Menge.
Zur Berücksichtigung der anderen Cs-Isotopen (Cs-136 und -134) sind noch deren Anteile und Halbwertszeiten einzubringen. Dazu berechnet man analog zu Cs-137 mit Gl. (2) deren Massen. Die so erhaltenen Massen werden entsprechend der Anteile der drei Isotope am Fall-Out gewichtet.
2118
F: Was ist Kanehl?
A: Kanehl (auch Kaneel geschrieben) ist ein anderer Name für Zimt.
Manchmal bezeichnet man damit auch die röhrenförmigen Zimtstangen (lat. canna, Röhre). Der Begriff Kaneel ist heute kaum noch
gebräuchlich. Man findet ihn eher noch in Ur-Omas Kochbüchern.
2119
F: Mein Sohn hat sich beim Spielen mit dem Saft unseres Weihnachtssterns bespritzt. Es trat eine
Rötung der Haut auf. Wie giftig ist der Saft?
A: Beim Weihnachtsstern handelt es sich um ein Wolfsmilchgewächs, erkenntlich an der weißen Milch,
die er bei Verletzungen ausblutet. Wolfsmilchgewächse sind im Allgemeinen ziemlich toxisch. Aber ausgerechnet der Weihnachtsstern ist eine Art,
die keine sonderliche Toxizität aufweist, da ihm die für die Giftigkeit notwendigen Di-ester bestimmter Terpene fehlen. Es kann seltener zu
leichten Kontaktallergien kommen - erkenntlich an der Rötung der betroffenen Hautstelle. Aus diesem Grunde machen Sie sich bitte keine Sorgen.
In solchen Fällen hilft Abwaschen mit Seife. Bei Augenkontakt würde ich mit warmem Wasser auswaschen und (ohne in Panik zu verfallen)
einen Augenarzt zu Rate ziehen.
Wesentlich anders ist das schon beim ebenfalls in vielen Häusern stehenden, beliebten Christusdorn.
2120
F: Warum nennt man Harnstoff Urea?
A: Wegen des allgemeinen Interesses haben wir hierzu eine Webseite gemacht. Klicken Sie hier.