 |
 |
 |
 |
| Kurze Fragen - Kurze Antworten
Aus dem E-Mail-Korb von Professor Blume |
651
F: Wenn in einem Gefäss eine Flüssigkeit ist, die bei ca. 70°C siedet
und diese unter Rückfluss steht; ändert sich die dann Reaktionsgeschwindigkeit bei einer Badtemperatur von 95°C
drastisch, oder überhaupt nicht ???
Gilt in diesem System auch die "RTG" - Regel ?
A: Wenn Sie unter Rückfluss kochen, bleibt im Reaktionsraum die
Temperatur von 70 °C konstant, auch wenn Sie draußen stärker erhitzen. Schließlich ist das die thermodynamisch
wohl definierte Gleichgewichtstemperatur des Übergangs der Flüssigkeit in den Dampfzustand. Sie ist nur vom
Druck abhängig.
Die RGT-Regel (oder auch Q10-Regel) beschreibt etwas grob die Abhängigkeit der
Reaktionsgeschwindigkeit von der Temperatur (vergleiche unsere Reaktionskinetik-Webseiten). Diese Regel
besagt, dass sich die Reaktionsgeschwindigkeit bei einer Temperaturerhöhung um 10 °C etwa verdoppelt. Hier
(also bei konstanter Temperatur!) die RGT-Regel anzuwenden ist also absolut sinnlos.
652
F: Ich hatte eine Diskussion über die nötige Spannung die an 2
Potentiale angelegt werden muss, damit sich im Wasser freie Ionen bilden. Wer liegt näher an der Wahrheit?
1,23 V oder 1,6 V?
Vielen Dank für ihre Bemühungen (Die Website gehört zum Besten :-)
A: Gute Frage! Aber vorneweg: Bitte beachten, dass es hier um
niedrige Spannungen geht!
Freie H+- und OH--Ionen sind immer im Wasser enthalten. Sie bilden sich nicht
erst dann aus dem Wasser, wenn man ein elektrisches Feld anlegt. Die Ionen, die sich an den Polen entladen,
sind in der Lösung auch vor der Anlegung der Spannung vorhanden. Das ist genau bei den Kristallen von Kochsalz.
Dessen Ionen bilden sich nicht erst, wenn Kochsalz sich löst, sondern sie liegen schon im Kristall vor und
bilden ein Ionengitter.
Die beiden Ionenformen bilden sich aus dem Wasser ausschließlich durch die bekannte
Säure/Base-Gleichgewichts-Reaktion des Wassers:
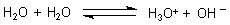
Die aufzuwendende Energie entspricht der der negativen Neutralisationswärme, allerdings bezogen auf Konzentrationen von 10-7 mol/l.
Da die Ionen durch das Entladen aus dem Gleichgewicht entfernt werden, werden sie während der Elektrolyse immer wieder nachgebildet, das Wasser wird somit nach und nach verbraucht. Das geht bei diesen kleinen Ionen-Konzentrationen sehr langsam. Will man effektivere Gasbildung durch Elektrolyse haben, so muss man die Konzentration der Ionen erhöhen - indem man zum Beispiel Säure zugibt. Schwefelsäure wirkt zusätzlich katalytisch. (Dazu haben wir eine Webseite in unserer Ozon-Webseitengruppe.)
Die Spannung von 1,23 Volt ist diejenige, die Sie bei der Entladung der Wasser-Ionen mindestens aufzuwenden haben. Da aber Reaktionshemmungen (hier als Entladungshemmung) auftreten, muss man eine höhere Energie aufwenden (Stichwort Aktivierungsenergie). Das erreicht man durch Spannungserhöhung (also z. B. 1,6 V) und hohe Wasser-Temperaturen (deshalb arbeitet man häufig auch bei hohem Druck). Die Aktivierungsenergie senkt man durch katalytisch wirkende Elektrodenoberflächen (Edelmetallelektroden).
Bei Anlegen einer Hochspannung sieht das Ganze allerdings anders aus...
653
F: Eisen kann man nur vergolden wenn man es davor verkupfert, aber
warum benetzt das Quecksilber (bei Feuervergoldung) das Eisen nicht??? Warum ist Verkupferung notwendig?
A: Voraussetzung zur Bildung von fest haftenden Überzügen ist die
Bildung von Legierungen. Darauf beruht ja auch das Löten.
Leider bildet Eisen weder mit Gold oder mit Quecksilber Legierungen. (Quecksilberlegierungen nennt man
Amalgame.) Wohl aber verbindet sich Kupfer sowohl mit Eisen als auch mit Quecksilber und mit Gold. (Das kann
man ausprobieren. Vorsicht aber bei Gold - ein Ehering ist dabei leicht ruiniert! Erklären Sie das mal Ihrer Frau...)
Folglich muss man zuvor verkupfern, damit das Goldamalgam greift. Beim Erhitzen wird dann das Quecksilber
abgedampft, und es bildet sich eine Kupfer-Gold-Legierung. Je mehr Goldamalgam man darauf gibt, desto goldener
wird der Überzug.
654
F: Bei der Schlagwortsuche "Bleizucker" bin ich auf Ihre Seite gestoßen.
Ich besitze eine umfangreiche Patronensammlung die mir einige Sorgen bereitet. Nach dem Einbringen der Sammlung
in hölzerne Schaukästen konnte ich einen verstärkten weißen Niederschlag auf den Bleigeschossen feststellen der
süßlich schmeckt. Die Kästen sind aus Buchenholz und nur mit Firnis und Wachs behandelt. Meine Frage besteht
darin, was kann die Ursache sein und wie kann ich den Prozess stoppen und den Niederschlag beseitigen. Über
eine Aussage zur Behandlung des Problems wäre ich unendlich dankbar.
A: Viele alte Hölzer werden mit stinkigem Essig und anderen Säuren
behandelt. Ich vermute, dass das Holz aus alten, zuvor lackierten Möbeln stammt, die zum Entfernen der
Altlackierung zunächst mit Lauge und dann zur Neutralisation mit Essigsäure behandelt wurden.
Ich habe selbst so ein neues Schränkchen erworben, das aus altem Tannenholz hergestellt wurde. Darin
haben wir zunächst u. a. Servietten und Papiertaschentücher aufbewahrt, bis wir gemerkt haben, dass die
bald nach Essig rochen.
Dieser Essig reicht aus, um zusammen mit Luftfeuchtigkeit Blei zu korrodieren.
Wenn ich Ihnen noch einen lebenswichtigen Tipp geben darf: Nichts von der Ausblühung probieren! Und
immer gut die Hände nach dem Berühren der Bleiteile waschen! Mit Bleivergiftung ist nicht zu spaßen.
Bleiverbindungen gehören auch zu den fruchtschädigenden Substanzen.
Ein Hinweis für Steinesammler: Solche Schränkchen sind auch nicht für die Aufbewahrung von Mineralien
geeignet! Die können sich chemisch verändern. So kann sich Markasit autokatalytisch zersetzen. (Dazu haben
wir eine -> Webseite.)
655
F: Unser Chemielehrer hat uns heute die Frage gestellt was mit einem Ei
passiert,wenn man es kocht und warum dann aus diesem gekochten Ei kein Küken mehr schlüpfen kann. Wissen Sie
die Anwort?ich wäre sehr dankbar.
A: Im Ei ist Eiweiß enthalten. Das Eiweiß hat zwei Aufgaben. Zum
einen ist es Speicher für die Bausteine, aus denen letztlich das Hühnchen im Ei entsteht. Weiter sind darin
Enzyme enthalten. Die sind notwendig, um die Umbauprozesse zu steuern und vor allem zu katalysieren. Dieses
Eiweiß wird ab 60 °C zerstört. Man sagt "denaturiert". Das erkennst du daran, dass es gerinnt, wenn du es
in heißes Wasser gibst. In einem gekochten Ei wird sich deshalb kein Küken, also kein Leben mehr entwickeln
können.
Du hast gehört, dass es auch in über 80 °C heißen Quellen lebende Bakterien gibt? Deren Eiweiße sind an
die hohen Temperaturen angepasst.