 |
| Bild 1: Kristalle von Pyrit. Der größte Kristall hat eine Kantenlänge von 3,5 cm
(Foto: Blume) |
Pyrit - Ein wichtiges sulfidisches Eisenerz
Eigenschaften und Entstehung von Pyrit und von Markasit
Experimente
Versuch: Schleifen eines Pyritkristalls
Versuch: Erhitzen von Pyrit
Versuch: Reduktion von Pyrit
Versuch: Eisensalze und Schwefelwasserstoff
Versuch: Herstellung von mineralisch wirkendem Bleiglanz
Versuch: Verwittern von Markasit
Versuch: Elektrische Leitfähigkeit von Mineralien
 |
| Bild 1: Kristalle von Pyrit. Der größte Kristall hat eine Kantenlänge von 3,5 cm
(Foto: Blume) |

|  |
Bild 2: Pyritisierte Versteinerungen. Links Perisphinctus-Ammoniten von der Schwäbischen Alb (max. Durchmesser 5 cm), rechts Seeigel aus der Schreibkreide von Møn (Länge des Seeigels 6 cm) (Fotos: Blume) |
Du hast vielleicht schon einmal die goldglänzenden Kristalle von Pyrit (Schwefelkies)
gesehen (siehe Bild 1). Viele Betrachter meinen, die Kristalle seien unecht und künstlich
zur perfekten geometrischen Figur geschliffen. Denn den Goldglanz des Pyrit kann man
nicht durch Schleifen herstellen: Wenn du nämlich einen Pyritkristall mit Schleifpapier
oder einer Feile bearbeitest, wird er schwarz und unansehnlich (siehe Experimente,
V 1 P).
Die chemische Zusammensetzung von Pyrit
Wir wollen untersuchen, woraus Pyrit besteht.
(1) Dazu erhitzen wir eine Probe des
Gesteins in einem Reagenzglas (siehe Experimente,
V 2 P).
Dabei beobachtest du zunächst abdampfende weiße
Nebel, die sich als gelbes Sublimat an der kalten Gefäßwand niederschlagen und dann
rotbraun schmelzen: Schwefel. Pyrit muss also Schwefel im Überschuss
gebunden enthalten (daher der Name "Schwefelkies").
(2) Erhitzt du unter Luftzufuhr
kräftig weiter, kannst du Schwefeldioxid riechen und auch nachweisen. Zugleich bildet sich
aus dem Pyrit ein fester, roter Stoff, den du mit Holzkohle zu Eisen reduzieren kannst:
Eisenoxid.
Pyrit enthält also die Elemente Eisen und Schwefel.
(3) Daraus leitest du vielleicht her, dass es sich um einfaches Eisensulfid FeS handelt. Das kannst du mit dem folgenden Versuch 3 P überprüfen: Übergieße unter dem Abzug Eisen(II)-sulfid mit etwas verdünnter Salzsäure; es bildet sich Schwefelwasserstoff. Anders ist es beim Pyrit, der sich hier als stabil erweist.
(4) Gibst du jedoch Zinkgranalien zur Pyrit-Säure-Mischung, wird der Pyrit durch die entstehenden aggressiven Wasserstoffatome "aufgeschlossen"; der Schwefelkies wird unter Bildung von Schwefelwasserstoff zersetzt.
Nun können wir auch die chemischen Reaktionen formulieren, die bei unseren Experimenten abgelaufen sind:
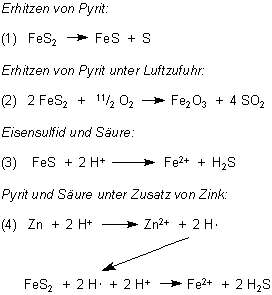
Aus den Versuchen leiten wir her, dass es sich beim Pyrit um ein schwefelreiches
Eisensulfid handeln muss. Tatsächlich ist seine chemische Formel FeS2.
Pyrit ist ionisch aufgebaut. Seine Kristalle bestehen aus Eisen(II)-Ionen Fe2+
und Disulfid-Ionen S22¯ (oder ¯S-S¯).
Die Kristalle des Pyrits
Die Formen der Kristalle, in denen Pyrit auftritt, sind besonders auffällig und
scheinbar sehr vielfältig. Es handelt sich hierbei aber nicht um verschiedene
Modifikationen,
denn alle Kristalle haben die gleichen physikalischen und chemischen Eigenschaften.
(Anders ist es beim Markasit; siehe weiter unten.)
Du findest zunächst Würfel (Bild 1 und Bild 3). Würfelförmige
Kristalle haben wir schon beim Kochsalz oder beim Magnesiumoxid gesehen.
Tatsächlich sind die Kristallgitter von Pyrit und von Kochsalz ähnlich aufgebaut. Beim
Pyrit wechseln sich regelmäßig Eisen(II)- und Disulfid-Ionen ab.
In der Natur und auf der Mineralienbörse findest du aber auch viele andere
Kristallformen, so z. B. Oktaeder (Achtflächner) und vor allem Pentagondodekaeder (Bild 3).
Letztere sind Körper, die (wie der Name besagt) aus 12 gleichseitigen Fünfecken
bestehen. Wir nennen diesen Kristalltyp kubisch. Kubisch heißt ein Kristall dann, wenn
es gelingt, in diesen Körper ein Achsenkreuz mit rechten Winkeln und gleichen
Seitenlängen hineinzulegen - wie du es beim Würfel sehen kannst (Bild 4).
(Wenn man beim Pentagondodekaeder die 12 gleichseitigen Fünfeckflächen durch 20
Sechseckflächen trennt, erhält man die Form eines Fußballs oder eines
Fullerens, der neuen Modifikation des Kohlenstoffs.)
Zum kubischen Kristallsystem siehe unsere Kristallwebseite.
 |
 |
 |
|
Bild 3: Pyritkristalle: Würfel, Oktaeder, Pentagondodekaeder
(Fotos: Blume) |
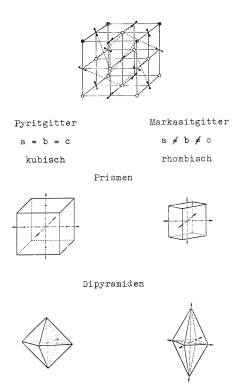
Bild 4: Vergleich von kubischem und rhombischem Kristallsystem beim FeS2
Oberes Bild: Anordnung der Disulfid-Ionen im Pyritgitter
Pyrit leitet den elektrischen Strom
Mineralien gelten allgemein als nicht magnetische Stoffe und (wenn man vom
Graphit absieht) auch als elektrische Isolatoren. Das
stimmt nicht in allen Fällen.
So gibt es Mineralien mit ausgeprägtem Magnetismus. Über den nach dieser Eigenschaft
benannten Magnetit (Fe3O4) berichten wir in einem
Tipp des Monats. Dazu gibt es auch noch den Magnetkies
(Fe0,9S).
Was die elektrische Leitfähigkeit angeht, stehen viele Mineralien wie Magnetit und Magnetkies
in ihren Eigenschaften zwischen den absoluten Nichtleitern (Isolatoren) und den Metallen. Ihre
elektrische Leitfähigkeit beträgt etwa 10 % der von Metallen. Hierzu gehört auch der Pyrit
(FeS2) (-> Versuch).
Die genannten Mineralien gehören aufgrund ihres Verhaltens zu den Elektronenleitern und hier
zu den metallischen Leitern. (Für Spezialisten: Ihre Valenz- und Leitungsbänder überlappen ein wenig.)
Beim Magnetit beschreiben wir genauer, wie bei ionisch aufgebauten Mineralien der Magnetismus
und der elektrische Strom entstehen.
Andere ionisch aufgebaute Mineralien leiten den Strom nicht, da Ionen wandern müssen. Und wenn
sie es leichter tun, dann nur bei höherer Spannung und weil sie Fehlstellen
enthalten.
Wie ist Pyrit entstanden?
Einmal durch vulkanische Tätigkeit, vor allem auch
in der Tiefsee beim Aufreißen von Erdspalten (hydrothermale Bildung). Aus den unterseeischen Erdspalten
entströmt viel Schwefelwasserstoff, der mit im Meerwasser ausreichend vorhandenen
Eisen-Ionen zu Sulfiden reagiert (siehe Experimente,
V 4 P). Diese lagern sich in langer Zeit in den Gesteinen, die
sich an den Meeressedimenten bilden,
zu Pyrit um. Dies kann man leider nicht im Labor zeigen. Mit dem Bleiglanz, dem Bleisulfid
PbS, gelingt das schon eher (siehe Experimente, V 5 P).
Bedeutend sind vor allem die Pyrit-Vorkommen, die auf bakterielle Tätigkeit zurückzuführen sind. Diese Lager sind so mächtig, dass der Pyrit weltweit mit zu den wichtigsten Eisenerzen gehört! (Die Geschichte der technischen Verwendung des Pyrits ist eng mit der Geschichte der Schwefelsäure verbunden.)
Voraussetzung zur Bildung des Pyrits, die auch heute noch
abläuft, sind anaerobe Bedingungen im Wasser. Hier wandeln Bakterien reichlich
vorhandene Eisen(III)-Ionen zu Eisen(II)-Ionen und Sulfat-Ionen zu Sulfid-Ionen um.
(Zu den biochemischen Hintergründen hierzu das Info!)
Da die Bakterien an abgestorbener Biomasse leben, scheiden sie besonders an
Lebensresten viel Eisensulfid als schwarzen Schlamm ab, wie man es ganz besonders
in eutrophierten ("umgekippten") Gewässern sehen kann. Ein Beispiel ist auch das
Schwarze Meer ab einer Tiefe von 50 m.
Der Schlamm wandelt sich im Verlaufe von Millionen von Jahren über die Vorstufe
Eisensulfid über eine weitere Vorstufe, Markasit, (arab. Feuerstein)
zu golden glänzenden Pyritkristallen
um. Aus diesem Grunde findet man in Tonsedimenten des Schwäbischen Jura, des
Teutoburger Waldes sowie in den Kreidefelsen von Rügen oder Møn (Dänemark)
herrliche Versteinerungen von Resten vergangener Lebewesen, die in Pyrit eingebettet
sind (Bild 2). Die folgenden Bilder zeigen typische Markasitaggregate.

Bild 5: Markasitsonnen. Durchmesser 10 cm
(Foto: Blume)

Bild 6: Markasitaggregat aus dem Kreidefelsen von Møn (Masse: 3200 g)
(Foto: Daggi)
Markasit ist instabil
Leider ist Markasit eine instabile Modifikation von Eisendisulfid. (Markasit heißt
nach der langen, nadeligen Kristallform auch Speerkies. Das
Kristallsystem ist rhombisch, während Pyrit kubisch ist.) Anders als der völlig
stabile Pyrit verwittert dieser sehr leicht, was viele Steinesammler feststellen müssen,
wenn in ihrer Sammlung Fossilien einfach zerfallen (Bild 7; siehe Experimente,
V 6 P). Das betrifft vor
allem "pyritisierte" Hölzer aus der Braunkohlezeit, aber auch Fossilien aus der
Schwäbischen Alb.

Bild 7: In einer Steinesammlung verwittertes fossiles Holzstück aus Markasit
(Foto: Blume)
Bemerkenswert ist, dass dieser Zerfall ebenfalls durch Bakterien ausgelöst wird.
Diesmal wirken die Bakterien andersherum, das heißt, sie oxidieren Disulfid zu Sulfat.
FeS2 + 3½ O2 + H2O ————> FeSO4 + H2SO4
Markasit bildet sich somit zu Eisen(II)-sulfat um. Die Schwefelsäure reagiert mit der Kalkfüllung des Fossils oder den Kalkschalen der Meerestiere zu voluminösen Gips. Beide Salze bilden grobe, weiße Kristalle, die das schöne Steinstück sprengen (Bild 8).

Bild 8: Verwitterter Pyritammonit (Amaltheus spec.).
Rechtes Bild: Der Ammonit zerfällt nach Berührung
(Fotos: Blume)
Außerdem wirkt die entstehende Schwefelsäure als Katalysator und beschleunigt die
Zerstörung. (Man spricht hier von Autokatalyse.)
Da Markasit besonders in der Braunkohle vorkommt, sind die Grubenabwässer wie im
Lausitzer Revier stark schwefelsauer, wie du selbst leicht nachprüfen kannst (siehe Experimente,
V 6 P; [3]). Die Reaktionswärme dieses exothermen Prozesses kann
zur Selbstentzündung der Kohle führen.
Pyritkristalle können auch wie Markasit aussehen
Markasit kann sich schon unter Normalbedingungen langsam (d. h. in Millionen von Jahren) in Pyrit umwandeln.
Das liegt daran, dass sich die Fe2+- und S22--Ionen im Kristallgitter auch ohne
Erhöhung von Druck und Temperatur leicht umgruppieren können. Man spricht von einer Pseudomorphose.
Dabei bleibt meistens die äußere rhombische Form der ursprünglichen Markasit-Kristalle erhalten. Dass eine Pseudomorphose
erfolgt ist, erkennt man daran, dass es Aggregate gibt, die über Jahrzehnte hinweg stabil bleiben, während echtes Markasit
normalerweise nach kurzer Zeit beginnt zu verrotten.
Ein Glück für Mineralien- und Fossiliensammler! Solch ein Stück zeigt Bild 6.
Wie kann man beide Mineralien unterscheiden, wenn sie sich ähneln? Kenner wissen: Pyrit ist völlig geruchlos, echtes Markasit dagegen riecht deutlich - nach Schwefelverbindungen und außerdem merkwürdig metallisch nach sauren Eisensalzen.

Bild 9: Verwitternde Markasitknolle (auf Møn)
(Foto: Daggi)
Pyrit ist ein goldhaltiges Mineral
Die chemischen Fähigkeiten oxidierender Bakterien nutzt man übrigens auch, um aus
Pyrit Gold abzutrennen. Denn in Pyrit ist in Spuren elementares Gold enthalten. Man
lässt Bakterien mit dem Namen Thiobacillus ferrooxidans auf feuchten, feingemahlenen
Pyrit unter Luftzutritt einwirken, wobei sie das Mineral zu löslichem Eisen(II)/(III)-sulfat
umsetzen. Das Sulfat wird mit Wasser herausgelöst, zurück bleibt Gold. So geht man in
einem großen Goldbergwerk in Nevada in den USA vor, das eigentlich eine riesige
Pyritlagerstätte ist [8].
Besuche zu Pyrit und Markasit auch die Mineral Gallery in den USA. (Beachte die englische Schreibweise: Pyrite, marcasite.)
Weitere Texte zum Thema „Pyrit und Feuerstein“