 |
| (Foto: Daggi) |
 |
| (Foto: Daggi) |
Versuch: Arbeiten mit brennbaren Gasen; Reduktion mit Wasserstoff
Demonstrationsversuch; 10 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Sachanalyse
Reduktionen von Metalloxiden mit Wasserstoff gehören zu den saubersten, weil das Wasser
abdestilliert und das Metall anschließend in reinster Form vorliegt. Aus diesem Grunde
lassen sich hiermit die Gesetze der konstanten sowie der multiplen Proportionen
besonders gut einführen. Als Metalloxide werden hierzu Kupfer(I)- und Kupfer(II)-oxid
eingesetzt.
Beim Handhaben von Wasserstoff sind einige elementare Regeln zu beachten, die
grundsätzlich für die Arbeit mit allen brennbaren Gasen, aber auch mit Stoffen, welche
wie Ether leicht verdampfen, gelten.
Grundsätzlich sollte beim offenen Hantieren mit Gasen keine Flamme in der Nähe
sein. Muss man die Gase wie im vorliegenden Versuch jedoch erhitzen, so muss auf
absolute Abwesenheit von Sauerstoff geachtet werden. Zur Prüfung wird üblicherweise die
Knallgasprobe durchgeführt: Brennt das Gas ruhig ab, so kann man davon
ausgehen, dass das Gas sauerstofffrei ist. Die Knallgasprobe ist jedoch relativ
unzuverlässig. Deshalb ist es besser, den Reaktionsraum
eine Minute lang mit dem Wasserstoff auszuspülen.
Die folgende Skizze zeigt den Versuchsaufbau:
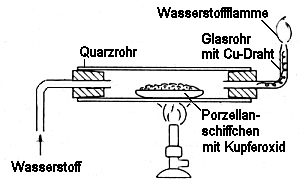
Schutzmaßnahmen:
Der Versuch sollte hinter der Sicherheitsscheibe durchgeführt werden.
Der Experimentator trägt unbedingt eine Schutzbrille.
Die intakten (!) Schläuche passend zu den Glasrohren wählen und mit Schellen befestigen. Der Zuführungsschlauch wird auf der Tischplatte fixiert (z. B. mit Klebeband).
Der Wasserstoffstrom wird grob eingeregelt, bevor der Gasschlauch an die Apparatur angeschlossen wird. Sonst kann der innere Gasdruck Stopfen lockern oder die Apparatur zerlegen. Feinregulierung darf bei geschlossener Apparatur nur vorgenommen werden, wenn das Ventil entsprechend in Ordnung ist.
Während des Versuches wird das Gas am ausgezogenen Glasrohr entzündet, da sich der Reaktionsverlauf anhand der Flammenfärbung sehr schön verfolgen lässt. Die Gaszufuhr ist so einzuregeln, dass die Flamme mindestens 5 cm hoch ist.
Der Wasserstoff darf aber erst entzündet werden, wenn man ihn mindestens 1 Minute lang durch die Apparatur hat strömen lassen.
Das Glasrohr darf nicht zu einer zu engen Kapillare ausgezogen sein, da die Gefahr des Zuschmelzens besteht. Der sich aufbauende Gasdruck könnte zum Lockern der Gummistopfen führen.
Besonders gefürchtet ist das Zurückschlagen der Flamme, wenn der Gasdruck schwankt oder zu niedrig ist. Dies verhindert man, indem man in das ausgezogene Glasrohr sowie in die Zuleitung Kupferlitze oder Eisenwolle hineinsteckt (Prinzip der Davyschen Grubenlampe).
Die Gummistopfen der Apparatur müssen des Öfteren erneuert werden, da sie wegen der Hitze spröde und folglich undicht werden! Sie dürfen auf keinen Fall gefettet oder anderweitig geschmiert werden, da sie dann nicht fest genug sitzen.
Gesprungene Quarzrohre nicht abschneiden. Dabei könnten Haarrisse, die beim Erhitzen der mit Wasserstoff gefüllten Apparatur aufspringen, übersehen werden. Besser ist es, solche Rohre durch einen Fachmann reparieren zu lassen oder sie einfach wegzuwerfen.
Geräte
Siehe Versuchsskizze; weiter Schlauchschellen, Stativmaterial, dazu eine Waage, Schutzbrillen.
Chemikalien
Wasserstoff (F+), Cu2O- sowie CuO-Pulver.
Durchführung
(Schutzbrille!)
Man wiegt zunächst ein Porzellanschiffchen leer und dann mit ca. 3 g Oxidpulver
genau ab. Nachdem man mit dem Wasserstoff die Apparatur luftfrei
gespült hat, entzündet man ihn an der Kapillare. Mit dem Feinventil an der Gasflasche
den Gasstrom über die Größe der Flamme einregeln.
Nun entzündet man den Bunsenbrenner, heizt das Quarzrohr vorsichtig unter Fächeln
auf und stellt dann auf volle Heizstärke. Die Flamme wird längs dem Schiffchen langsam
hin und her geführt.
Wenn das Kupferoxid ausreichend erhitzt worden ist, setzt unter deutlichem Aufglühen
die exotherme Reduktion ein. Eventuell muss man weitererhitzen! Die Flamme wird deutlich kleiner.
Gleichzeitig färbt sie sich solange, wie die Reduktion läuft, intensiv grün (-> Bild).
Danach ist die Reaktion beendet. Um sicherzustellen, dass auch alles Kupferoxid reduziert
worden ist, erhitzt man die Kupferprobe noch weiter und führt dazu die Brennerflamme
zwei-drei Mal langsam unter dem Schiffchen entlang. Erst dann lässt man im Wasserstoffstrom abkühlen.
Die Reaktionsgleichung der exothermen Reduktion ist
CuO + H2 ———> Cu + H2O + Energie
Das Reaktionswasser erkennt man deutlich als Kondensat im vorderen Rohrteil und im Auslassröhrchen.
 |
| (Foto: Daggi) |
Als erste Maßnahme nach der Reaktion die Flamme des Bunsenbrenners ausstellen.
Auf keinen Fall sofort die Apparatur öffnen, da das Kupfer
sonst wieder oxidiert wird! Zuvor ist das glühende Reduktionsprodukt im
Wasserstoffstrom abzukühlen. Deshalb muss der Wasserstoffstrom noch mindestens
5 Minuten nach Reaktionsende aufrechterhalten werden.
Man kippt dann das Verbrennungsrohr etwas, so dass die Öffnung mit Flamme nach oben zeigt und löst den unteren Stopfen. Dann wird sofort das Ventil der Druckflasche geschlossen.
Nach dem Abkühlen wird das Kupfer samt Porzellanschiffchen gewogen.
Hinweis
Die Wiederholung des Versuches mit einer anderen Einwaage des gleichen Kupferoxids zeigt,
dass das Massenverhältnis von Kupfer zu Kupferoxid stets konstant bleibt (Gesetz der
konstanten Proportionen). Vergleicht man die Verhältnisse für beide verschiedenen Kupferoxide,
so erhält man das Gesetz der multiplen Proportionen. Beim Kupfer(I)-oxid
Cu2O sollte man wegen des kleinen Sauerstoffanteils an der Gesamtmasse aus Gründen
der Messgenauigkeit mindestens 5 g einwiegen.
Die Messergebnisse und Auswertungen finden Sie auf einer besonderen Webseite.