| Versuch: | Anreicherung von Kupfer-Ionen mit einem flüssigen,
komplexierenden Ionenaustauscher |
Schülerversuch; 10 min.
Beim Experimentieren den Allgemeinen Warnhinweis unbedingt beachten.
Grundlage
Zur Extraktion von Kupfer aus wässrigen Lösungen wird hier anstelle der üblichen festen
Ionenaustauscher ein in einer nichtwässrigen und zugleich wasserunlöslichen Phase gelöster
Ionenaustauscher verwendet. Damit findet eine den Ionenaustausch begleitende Extraktion statt.
Anstelle des in der Technik verwendeten Austauschers benutzen wir das leicht
erhältliche Bis(2-ethylhexyl)hydrogenphosphat. Dann müssen wir aber auch anstelle einer
schwefelsauren Kupfersulfatlösung mit einer wässrigen Kupferacetatlösung arbeiten. Folgende
Gleichgewichtsreaktion läuft ab:
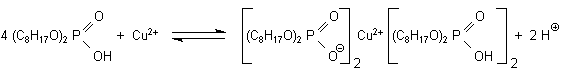
Lösemittel ist n-Heptan. Die Rückreaktion erfolgt durch Ansäuern mit verdünnter Schwefelsäure. Im Unterricht kann man an die Rückextraktion noch die bekannte elektrolytische Raffination des Kupfers anschließen.
Geräte
Schütteltrichter (500 ml), Erlenmeyerkolben (500 ml), für den Schülerversuch: 2
Reagenzgläser mit Stopfen, Tropfpipette.
Chemikalien
Kupferacetatlösung (c = 0,01 mol/l) (Xn), Schwefelsäure (c = 1 mol/l) (C),
Bis(2-ethylhexyl)hydrogenphosphat (z. B. von Serva 15086), n-Heptan (F).
Durchführung
Zunächst musst du den flüssigen Ionenaustauscher mit n-Heptan auf das zehnfache
Volumen verdünnen.
Zehn Teile der Kupferacetatlösung werden mit zwei Teilen der
Ionenaustauscherlösung in den Schütteltrichter gegeben und kräftig geschüttelt.
Nachdem sich die Phasen getrennt haben, ist die organische (obere) Phase blau
gefärbt, die wässrige Phase entfärbt. Man lässt die untere Phase in einen
Erlenmeyerkolben ab und schüttelt die organische Phase mit dem halben Volumen
Schwefelsäure. Nach kurzem Schütteln ist die Rückextraktion beendet. Das
Kupfersalz befindet sich nun in der Schwefelsäure-Phase und liegt in
konzentrierterer Form als in der Ausgangslösung vor.