| Die Indigo-Küpe | 
|
Experimente:
Versuch: Küpenfärbung mit Indigo
In Wasser unlösliche Farbstoffe bringt man auf die Faser, indem man sie zuvor in eine lösliche (meist mehr oder weniger farblose)
"Leukoform" überführt. Dies geschieht z. B. durch Reduktion in einer Lösung ("Küpe").
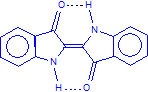
Das klassische Beispiel hierfür ist Indigo. Dessen phenolische Form („Indigweiß“ oder „Leukoindigo“) sowie das sich im alkalischen Milieu daraus bildende gelbe Anion sind anders als Indigo wasserlöslich. (Man sollte sich nicht daran stören, dass Indigweiß nicht farblos bzw. weiß, sondern gelb ist. Klicken Sie dazu hier.)
Früher dienten als Reduktionsmittel anaerobe Bakterien, die in einer stinkenden Brühe wie z. B. Harn lebten. Färben war eine unappetitliche Sache - wie auch das Gerben von Leder.
Später nahm man Kalkstein als Alkali und Eisen(II)-sulfat („Eisenvitriol“) als Reduktionsmittel ("Vitriolküpe").
Heute verwendet man im Allgemeinen als Reduktionsmittel Natriumdithionit. Klick den Versuch an.
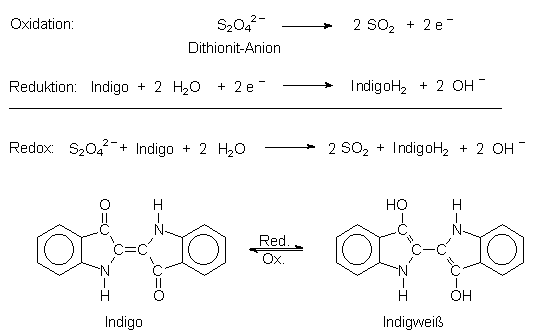
Reaktionen in der Indigo-Küpe
Nach dem Auftragen des Leukoindigos wird die Textilie in der frischen Luft mit Sauerstoff in Kontakt gebracht ("Verhängen"),
wodurch sich der Farbstoff zurückbildet.

Indigo-Küpe
(Foto: Daggi)
Es tauchte in diesem Zusammenhang oft die Frage auf, ob beim Färben SO2-Gas entsteht oder ob es auch möglich ist, dass die
Dithionit-Ionen zu SO32- reduziert werden. Natürlich entstehen dabei vorrangig HSO3-
und SO32-, denn man arbeitet ja im alkalischen Milieu. Wenn wir aber dies noch in die Redoxgleichung (siehe oben)
geschrieben hätten, wäre sie zu kompliziert geworden.
Weitere Texte zum Thema „Indigo“