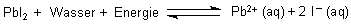
Nicht alle Salze verhalten sich beim Erhitzen ihrer Lösungen regelkonform
Experimente:
Versuch: Verhalten von Bleiiodid-Lösungen
Versuch: Erwärmen von calciumhydrogenhaltigem Mineralwasser
Versuch: Entkalken mit Citronensäure?
Ein Vater hat vor kurzem Folgendes geschrieben: "In einer Klassenarbeit meiner
Tochter wurde folgende Frage gestellt: Wie verhält sich eine gesättigte Lösung
beim Erwärmen?
Die richtige Antwort sollte lauten, dass Bodensatz in Lösung geht. Ich denke,
das stimmt so pauschal nicht, denn es gibt auch Stoffe die in der Wärme
ausfallen. Mir fällt nur keiner mehr ein."
Der Allgemeinfall ist tatsächlich der in der Klassenarbeit gewünschte Ablauf: Schwerlösliche Salze (wie Bleisulfat, Bleiiodid oder Gips) lösen sich deutlich besser, wenn man ihre gesättigte Lösung (also solche mit Bodensatz!) erhitzt. Dabei muss man einkalkulieren, dass das Wasser nicht verkochen darf. Denn das Lösen dauert seine Zeit. Deshalb muss man - wie wir sagen - "am Rückfluss kochen", damit das absiedende Wasser immer wieder kondensiert und in die Lösung zurückfließt.
Bei dem Lösen handelt es sich eigentlich nur um einen vorrangig physikalischen Vorgang: Ein schwerlösliches Salz löst sich in der Wärme und fällt in der Kälte wieder aus. Ein optisch prächtiges Beispiel ist das Bleiiodid.
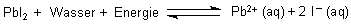
Den Versuch zu diesem Lösungsgleichgewicht beschreiben wir in unserem Tipp des Monats: April 2002.
Es gibt aber tatsächlich Salze, die sich anders - quasi
verdreht - verhalten: Sie sind in der Kälte löslich und fallen in der Hitze aus.
Das bekannteste Beispiel ist die Lösung von Calciumhydrogencarbonat.
Das Salz ist leicht löslich und in mineralreichen Mineralwässern wie Gerolsteiner
enthalten. Es bildet beim Erhitzen schwerlösliches Calciumcarbonat (- > Versuch).
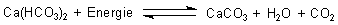
(Dieses Gleichgewicht spielt auch eine wichtige Rolle bei der Sedimentbildung und bei der Entstehung von Tropfsteinhöhlen. Lies dazu die Webseite.)
Zweites Beispiel: Wenn man Kalkstein in der Kälte mit Citronensäure zersetzt, bekommt man automatisch Lösungen, die statt freier Calcium- und Citrat-Ionen das Calciumcitratkomplex-Anion [Ca(cit)2]4- enthalten.
CaCO3 + 2 H3cit ———> [Ca(cit)2]4- + 4 H+ + H2O + CO2 + Energie
(Die Abkürzung cit steht für das Citrat-Anion.)
Beim Erhitzen bildet sich daraus schwerlösliches Calciumcitrat (-> Versuch).
3 [Ca(cit)2]4- + 12 H+ + Energie ———> Ca3(cit)2 + 4 H3cit
(Das zu wissen ist wichtig, wenn man Kaffeemaschinen mit Citronensäure entkalken will. Dabei zersetzt man zwar den Kalk; es bilden sich stattdessen aber erst recht störende voluminöse weiße Niederschläge, die die Leitungen zusetzen.)
Es wird also deutlich, dass bei Lösungen von Calciumhydrogencarbonat und Calciumcitrat(komplex) (anders als bei den gesättigten Lösungen von Salzen wie Bleisulfat, Bleiiodid oder Gips) zu den physikalischen Lösungsabläufen zusätzliche chemische, also stoffverändernde Prozesse ablaufen, die letztlich für das Ausfallen der Salze in der Hitze verantwortlich sind.
Die dabei gebildeten schwerlöslichen Salze (Calciumcarbonat bzw. Calciumcitrat) verhalten sich dann in ihrer gesättigten Lösung wie die regulären Salze: Sie lösen sich zunehmend bei Erwärmung ihrer Lösungen.
Fazit
Die zwei genannten Beispiele sind nur Ausnahmen - ich würde deswegen keinen
Aufstand machen. Vor allem kann Ihre Tochter viel über das chemische
Gleichgewicht lernen, wenn sie sich anstelle von den wenigen Ausnahmen zunächst
einmal das reguläre Verhalten von gesättigten Salzlösungen merkt - egal, wie interessant
und anwendungsbezogen das Irreguläre auch sein mag...
Weitere Texte zum Thema „Chemisches Gleichgewicht und Massenwirkungsgesetz“