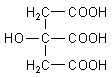
Eigenschaften der Citronensäure
Experimente:
Versuch: Citronensäure reagiert sauer
Versuch: Reaktion von Cerammonium-Reagenz mit Citronensäure
Versuch: Kristallisation von Citronensäure
Versuch: Schmelzpunktbestimmung von Citronensäure
Versuch: Geheimtinte
Versuch: Citronensäure reagiert mit unedlen Metallen
Versuch: Citronensäure als Komplexbildner
Versuch: Citronensäure als Rostentferner
Versuch: Auflösen von Kalkstein mit Citronensäure
Versuch: Entkalken mit Citronensäure?
Versuch: Warum man Kaffeemaschinen nicht mit Citronensäure
entkalken sollte
Versuch: Herstellung von Calciumcitrat aus Zitronensaft
Versuch: Auflösen von Calciumcitrat in Citronensäurelösung
Versuch: Die elementare Zusammensetzung von Citronensäure
Versuch: Fotometrische Bestimmung von Citronensäure
Versuch: Reaktion von Cerammonium-Reagenz mit Citronensäure
Reine Citronensäure ist ein farbloser kristalliner Feststoff. Wenn man sie erhitzt,
wird deutlich, dass sie aus den Elementen C, H und O besteht (-> Versuch).
Ihre Lösungen färben Lackmuslösungen oder Universalindikatorpapier rot (-> Versuch).
Sie ist also eine organische Säure, eine Carbonsäure. Mit Cernitratreagenz
erhalten wir eine Rotfärbung, die auf das Vorliegen einer alkoholischen Hydroxylgruppe hinweist (siehe unten).
Ihr systematischer Name ist 2-Hydroxy-propan-tricarbonsäure, denn sie ist eine dreibasige Säure.
Das Molekül der Citronensäure zeichnet eine hohe Symmetrie aus. Das erkennt man an der wunderschönen
Strukturformel.
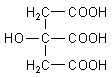
(Damit wir nicht immer diese große Formel benutzen müssen, kürzen wir Citronensäure in Reaktionsgleichungen mit CitH3 ab.)
Es gibt übrigens auch eine isomere Citronensäure, die aus dem Citronensäure-Zyclus bekannte iso-Citronensäure.
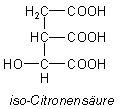
Diese ist optisch aktiv, da sie ein Asymmetriezentrum enthält. Deshalb gibt es zwei Formen. In biochemischen Reaktionszyclen wird nur die L-Form synthetisiert und umgesetzt.
Citronensäure löst sich leicht in Wasser und Alkohol. Aus wässrigen Lösungen kristallisiert Citronensäure als Monohydrat CitH3 · H2O in Form von langen, strahlförmig angeordneten Nadeln aus (-> Versuch).
Normalerweise kauft man Citronensäure als Monohydrat. Sie ist aber auch wasserfrei erhältlich. Wasserfreie Citronensäure unterscheidet sich vom Monohydrat im Schmelzpunkt und in der Dichte. Das Monohydrat besitzt einen Schmelzpunkt von 100 °C, während wasserfreie Citronensäure einen Schmelzpunkt von 153 °C hat (-> Versuch). Bei Temperaturen über 175 °C wird sie zersetzt. Diese Eigenschaft ist Grundlage für die Verwendung von Zitronensaft als Geheimtinte (-> Versuch).
Citronensäure ist eine schwache Säure, also nicht vollständig dissoziiert. Sie wirkt aber recht stark und greift viele unedle Metalle wie zum Beispiel Magnesium oder Calcium an (-> Versuch).
Sie bildet mit vielen Metall-Ionen (z. B. Fe3+, Cu2+, Ca2+) wasserlösliche Dicitrato-Komplexe (-> Versuch).
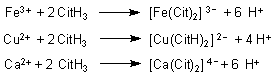
Deshalb löst sich Calciumcitrat in Citronensäurelösung auf (-> Versuch). Der so gebildete Calcium-dicitrato-Komplex sieht wie folgt aus:
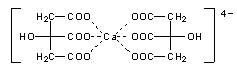
Es handelt sich um einen Chelatkomplex.
Die Carboxylatgruppen ordnen sich oktaedrisch um das Zentral-Ion an.
Auf dieser Komplexbildung beruht auch die zerstörerische Wirkung
von Citronensäure auf den Zahnschmelz (Karies).
Beim Kupfer gibt es aufgrund der Komplexierung mit Citrat eine intensive Farbvertiefung. Dieser Kupferkomplex ist in der Benedict-Lösung, einem Nachweisreagenz für Zucker, enthalten.
Bei Zugabe von Eisen(III)-Ionen zu Citronensäure beobachtet man ebenfalls eine
Farbvertiefung der an sich schon gelblichen Eisensalzlösung. Darauf beruht ein
colorimetrisches Verfahren zur Konzentrationsbestimmung (-> Versuch).
Die Reaktion mit Eisen-Ionen ist Grundlage für die Verwendung der
Citronensäure als Bestandteil von Rostentfernern (-> Versuch).
Diese Komplexe sind nicht stabil. Aus ihnen können sich beim Erhitzen schwerlösliche Salze
bilden. Das hat im Falle des Calcium-Komplexes besondere Folgen:
Wie andere Säuren auch reagiert Citronensäure mit Calciumoxid sowie mit Kalk
(-> Versuch).
Dabei bildet sich zunächst der lösliche Calcium-Dicitrato-Komplex:
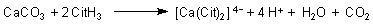
Da die dabei entstehenden Reaktionsprodukte gesundheitlich unbedenklich sind, könnte man daran denken, Citronensäure als Entkalker für Kaffeemaschinen zu nutzen. Solche Entkalker gibt es wirklich im Angebot von Supermärkten. Aber die zu kaufen, bedeutet Geld zum Fenster "rauszuwerfen": Denn beim Erhitzen während des Entkalkens fällt sofort schwer lösliches Calciumcitrat aus, das die Leitungen in der Kaffeemaschine anstelle des Kalks erst recht und nachhaltig verstopft (-> Versuch).
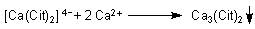
Die Löslichkeit von Calciumcitrat-tetrahydrat beträgt bei Zimmertemperatur 0,96 g/l Wasser. (Zum Heiß-Entkalken haben wir noch eine besondere Webseite.)
Dieses Verhalten der Komplexe nutzt man auch zur Abtrennung von Citronensäure aus Zitronensaft aus (-> Versuch).
Citronensäure spielt eine zentrale Rolle im menschlichen Stoffwechsel. Es wurde sogar ein Stoffwechselprozess nach ihr benannt: der Citronensäure-Zyklus. Im Rahmen dieses Zyklus bildet der menschliche Körper täglich etwa 2 kg Citronensäure als Zwischenprodukt, das sofort wieder abgebaut wird.
Citronensäure ist eine der am weitesten verbreiteten Pflanzensäuren: Sie kommt in der Natur hauptsächlich im Zitronensaft (Citronensäuregehalt 5-7 %), aber auch in anderen Früchten, in Milch, Nadelhölzern und vielen anderen Pflanzen vor.
Bis zur Mitte des 20. Jahrhunderts wurde Citronensäure ausschließlich durch Isolierung aus Zitronensaft gewonnen. Inzwischen spielt dieses Verfahren in der Industrie kaum noch eine Rolle, da es heute möglich ist, mit Hilfe von Mikroorganismen große Mengen Citronensäure aus Zucker oder zuckerhaltigen Stoffen herzustellen (-> Webseite). 90 % der benötigten Citronensäure werden heute auf diese Weise produziert.
Citronensäure wird für viele Zwecke verwendet: Etwa 60 - 70 % der Weltjahresproduktion von rund 600.000 t wird von der Lebensmittelindustrie verwendet. Citronensäure gilt als Lebensmittel und darf ohne mengenmäßige Begrenzung anderen Lebensmitteln zugesetzt werden. Weitere Anwendungsgebiete der Citronensäure sind in der Kosmetik, in der Metallurgie und in der Pharmazie. Diese Anwendungsgebiete werden später näher beschrieben. Außerdem benutzt man Citronensäure zum Entfernen von Tintenflecken. Im Haushalt dient sie als Bestandteil von Entkalkern, Klarspülern in der Geschirrspülmaschine und als Badreiniger.
Stimmt die folgende Meldung? Gibt es das: Bekämpfung eines sauren Milieus durch eine Säure?
|
Zitronensaft neutralisiert Magensäure
|
Die Citronensäure ist, wie der Name sagt, eine Säure, im chemischen Sinne sogar nur eine schwache Säure. Pufferwirkung zeigen nur Salze von schwachen Säuren. Also: Die Meldung ist nicht richtig! Wer unter Sodbrennen aufgrund von zuviel starker Salzsäure leidet, sollte auf keinen Fall Zitronensaft trinken. Das verschlimmert alles nur! Besser sind echte Puffer wie Hydrogencarbonat (Bullrichs Salz).
Kann man auch nachweisen, dass die Citronensäure eine alkoholische
Gruppe trägt?
Dazu nutzen wir die bekannte Reaktion von Alkoholen mit Cerammoniumreagenz (-> Versuch).
Zur Chemie dieser Nachweisreaktion siehe unseren Tipp des Monats.
Tatsächlich bildet sich wie erwartet auch eine rote Farbe aus - die aber aufgrund der leichten
Oxidierbarkeit der Citronensäure rasch verfliegt. Merkwürdigerweise bildet sich
dabei keine farblose Cer(III)-Lösung, sondern ein tiefgelber Cer(III)-Citrat-Komplex, der wie eine
Cer(IV)-Lösung aussieht.
Weitere Texte zum Thema „Zitrone“