Prof. Blumes Tipp des Monats Juli 1997 (Tipp-Nr. 1)
Beim Experimentieren den Allgemeinen Warnhinweis
unbedingt beachten.
Zur Spezifität des Nachweises von Alkoholen mit Cerammonium-Reagenz
Diese Untersuchung kann auch von Schülern vorgenommen werden.
Die Reaktion von Alkoholen mit einer salpetersauren Lösung von Cer(IV)-ammoniumnitrat ist ein bekannter Nachweis für diese organische Stoffgruppe. Dabei bildet sich eine Komplexverbindung, die tiefrot gefärbt ist. Die Zusammensetzung ist etwa:

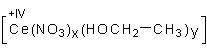
Zur Herstellung der Lösung gehen wir von käuflichem Cerammoniumnitrat aus. Diese Bezeichnung ist zwar gängig, aber nicht ganz richtig. Denn es handelt sich bei diesem Salz um eine Komplexverbindung:
(NH4)2[Ce(NO3)6]
Aus gegebenem Anlass sei darauf hingewiesen, dass man beim Nitrat bleiben muss, denn nur damit bildet sich der hier beschriebene Alkohol-Komplex. Es gibt nämlich auch Ammoniumcer(IV)-sulfat Dihydrat (NH4)4[Ce(SO4)4] · 2 H2O zu kaufen. Das löst sich schlecht in Salpetersäure und zeigt auch die gewünschte Nachweisreaktion nicht.
|
Herstellung des Cerammoniumnitrat-Reagenz
Versuchsdurchführung
|
 |
| Cer(IV)-nitrat-Lösung mit
Ethanol (links) und Wasser (rechts)
(Foto: Sandra) |
Beispiel für die Anwendung der Probe
| 1. | Nachweisreaktion bei der Einführung der Alkohole [2] |
| 2. | Nachweis von Glycerin bei der Fettspaltung; bei der alkalischen Hydrolyse neutralisieren und abkühlen lassen! [3] |
| 3. | Nachweis von Glykol bei der Hydrolyse von Terephthalsäureglykolester (Polyethenterephthalat PET, [4]) |
Problem
Diese Reaktion läuft dem Vernehmen nach allerdings auch mit Aldehyden ab [1]. Dieser
Hinweis hat offensichtlich verschiedene Lehrer und Referendare verunsichert. Denn der
Alkohol-Nachweis mit Cerammoniumnitrat gilt in der Schulchemie als sehr spezifisch.
Um dies zu untersuchen, wird wie folgt vorgegangen.
|
1 ml Ethanol bzw. Acetaldehyd werden mit 5 ml destilliertem Wasser versetzt. In ein drittes Glas gibt man 6 ml Wasser. Dann gibt man jeweils 5 ml des Reagenzes zu und vermischt gut. Die Farbe wird sofort beurteilt, da sie mit der Zeit verblasst. Ergebnisse
Fazit
|
Das Fazit lässt sich noch anders begründen:
Die Lösung im ersten Reagenzglas entfärbt sich innerhalb einer Stunde weitgehend. Grund ist,
dass Cer(IV)-Ionen den Alkohol zu Aldehyd oxidieren. Deshalb stellt man im ersten
Reagenzglas bald einen deutlich stechenden Geruch nach Aldehyden fest. Die Redoxgleichung
lautet:

Der Komplex zerfällt in dem Maße, wie sich der Aldehyd bildet. Deshalb entfärbt sich die tiefrote Lösung.
Wäre der Nachweis auf Aldehyden dem von Alkoholen gleichwertig, dürfte sich die Lösung nicht so rasch entfärben, sondern müsste über eine gewisse Zeit hinweg eine Färbung bewahren. Obwohl die Lösung schließlich weitgehend farblos ist, riecht sie deutlich nach Aldehyd. Sie müsste also mit überschüssigem Cer(IV)-Ionen eine Färbung ergeben.
|
Nachweis des entstehenden Aldehyds
Hinweis
|
Dieser Versuch ist zugleich eine schöne Möglichkeit zur Herstellung von Aldehyden.
Rüdiger Blume